Fizikai Szemle 2007/6. 191.o.
A FIZIKUS SZEREPE A DAGANATOS
BETEGEK GYÓGYÍTÁSÁBAN
Balogh Éva
Jósa András Megyei Kórház,
Onkoradiológiai Osztály, Nyíregyháza
Angeli István
Debreceni Egyetem, Kísérleti Fizika Tanszék
A civilizációs ártalmaknak, a megváltozott életvitelnek
tulajdonítható, hogy egyre nő a daganatos megbetegedések
száma. A rosszindulatú daganatos betegségek
hazánkban a második helyet foglalják el a halálozási
okok között. Az egyre szélesebb körű felvilágosítás,
a szűrővizsgálatok fontosságának hangsúlyozása
az oka annak, hogy az onkológiai centrumokban egyre
többen jelentkeznek még a betegség kezdeti stádiumában.
Ennek és az orvostudomány, valamint a
technika fejlődésének köszönhető, hogy egyre javul a
betegek gyógyulásának esélye.
A röntgensugárzást már az 1900-as évek elejétől
használják gyógyítási célokra. A sugárterápiában sejtpusztító
hatását hasznosítják, amelyet a DNS közvetlen,
illetve közvetett károsító hatása révén ér el. Az ép
és daganatos sejtek között sugárérzékenység szempontjából
ugyan van különbség, a kezelés során
azonban az ép szövetek is károsodhatnak, ezért a
sugárterápia célját így fogalmazhatjuk meg: minél
nagyobb, homogén eloszlású dózist (sugárterhelést)
leadni a céltérfogatra, ugyanakkor elérni, hogy a környező
szövet sugárterhelése a lehetséges legalacsonyabb
legyen, mert a daganatos sejteket oly módon
kívánjuk elpusztítani, hogy az ép szövetek sejtjei még
képesek legyenek regenerálódni, "újraépülni".
Sugárterápiás gyógyításban a daganatos betegek
körülbelül 60%-a részesül. A sugárterápiás kezelések
két nagy csoportra oszthatók: a teleterápiára (a sugárforrás
a besugárzandó területen kívül helyezkedik el)
és az üregi kezelésre (brachyterápia, ahol a sugárforrás
a besugárzandó területen belül helyezkedik el).
Talán kevesek gondolnák, hogy a kezelésben résztvevő
egészségügyi végzettségű személyzeten kívül a
fizikusnak is aktív szerepe van az onkoradiológiai
osztályok betegeinek gyógyításában.
A fizikus feladatai:
- a sugárterápiás készülékek dozimetriai paramétereinek
bemérése és folyamatos ellenőrzése,
- a besugárzási terv elkészítése,
- a sugárkezelés minőségbiztosítási eljárásának
összeállítása.
Ezek közül a minőségszabályozás a sugárterápián
belül az alábbi területekre osztható:
- teleterápiás egységek (gyorsítók, szimulátor)
mechanikai, geometriai és dozimetriai vizsgálata,
rendszeres ellenőrzése,
- brachyterápiás rendszer,
- besugárzástervező rendszer ellenőrzése, valamint
- sugárvédelmi feladatok (a betegre és a személyzetre
vonatkozóan).
Ezen feladatok mindegyikének részletes bemutatása
meghaladná egy ilyen rövid cikk kereteit, ezért
csak a teleterápiás kezelésre kerülő betegekkel kapcsolatos
fontosabb fizikusi feladatokkal foglalkozunk.
A beteg útja az onkoradiológiai osztályokon
A sugárkezelés komplex folyamat, amelyet röviden így
vázolhatunk: miután diagnosztizálták a daganatos megbetegedést,
az orvoscsoport a rendelkezésére álló információk
birtokában mérlegel és dönt, hogy a lehetséges
kezelések közül melyiket alkalmazzák. Ezek lehetnek:
- műtét,
- kemoterápia (daganatgátló, daganatpusztító
gyógyszerek),
- sugárkezelés,
- ezek megfelelő kombinációja.
A fizikusnak akkor van szerepe a gyógyításban, ha a
beteg sugárkezelésben részesül. Ilyenkor az orvos elsődleges
feladata a daganat helyének pontos meghatározása,
amelyet az igénybe vehető képalkotó eljárások
segítségével határoz meg. A legtöbb esetben a komputertomográfiát
(CT) alkalmazzák. Az elkészült felvételek
alapján meghatározza és berajzolja - akár több síkban
- a célterületet, valamint a kezelés folyamán védeni
kívánt érzékeny területeket. A terapeuta dönt, hogy
milyen nagyságú legyen a besugárzási mező, a kezelés
során milyen energiát javasol alkalmazni, milyen napi
dózisban, hány alkalommal (frakcióban). Az orvos (ha
a terv szerint szükséges) blokkot, takarást javasolhat a
védendő területek sugárterhelésének csökkentésére. A
megadott adatok alapján a fizikus elkészíti a kezelési
tervet. Az orvos a kész terv alapján szimulációval ellenőrzi
annak helyességét (erre átvilágító röntgenberendezést használ
a besugárzási geometriával azonos elrendezésben)
és jóváhagyja, vagy dönt az esetleges változásokról.
Ha a terv megfelelő, akkor ezt a betegre megfelelő
jelölésekkel "felrajzolja", és ezt követően kezdődik
a beteg sugárterápiás kezelése.
A teleterápiás kezeléshez rendelkezésünkre
álló eszközök
Lineáris gyorsító
Teleterápiás kezelésre az onkoradiológia osztályokon
jelenleg (a kobaltágyúkat szinte már teljesen kiszorító)
lineáris gyorsítókat alkalmaznak. Ezek a készülékek
elektron- és fotonsugárzás (fékezési röntgensugárzás)
előállítására képesek. (A nyíregyházi Jósa
András Oktató Kórház Onkoradiológiai Osztályán két
Siemens lineáris gyorsító működik.)
Az elektronágyúból kilépő elektronokat egy vákuumra
leszívott gyorsítócsőben nagyfrekvenciás elektromágneses
hullámok gyorsítják fel. Ahhoz, hogy egy
lineáris gyorsító a sugárterápiás követelményeknek
megfelelő, kellően stabil és ellenőrzött elektron- vagy
fotonsugárzást szolgáltasson, a gyorsítót különféle kiegészítő
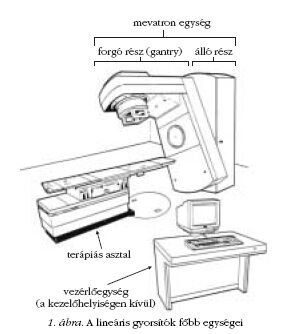
és vezérlő elemekkel látják el. Az 1. ábrán a
nyíregyházi onkoradiológiai osztályon működő egyik
gyorsítóberendezés vázlatos ábrája látható.
A berendezés saját dozimetriai rendszerrel van ellátva,
amely folyamatosan ellenőrzi a besugárzási
mező dózisállandóságát, homogenitását és hiba esetén
megszakítja a kezelést. A gyorsítócső a 360°-os
szögtartományban elforgatható gantry-ben foglal helyet.
A berendezés alkalmas állandó fókusz-bőr távolságú
(FBT) álló, izocentrikus álló- és mozgómezős
besugárzásra. A felgyorsított elektronokat a gyorsítócső
végénél elhelyezett eltérítő elektromágnes 270°-kal
eltéríti, így a sugárnyaláb a cső tengelyére merőlegesen
lép ki a gyorsítóból.
A 270°-os eltérítés révén 2-3%-on belül monoenergetikus,
körülbelül 1,5 mm átmérőjű elektronnyalábot
kapunk. A besugárzófej (2. ábra) főbb részei a motorikusan
mozgatható wolfram céltárgy (target), az előkollimátor,
a szűrőváltó, a dózismonitor (a leadott dózis
mérésére és szabályozására), a tükör és a főkollimátor.
Fotonsugárzás alkalmazása esetén a céltárgyat az
elektronnyaláb útjába, annak fókuszpontjába helyezzük,
így 6, illetve 15 MeV-os fotonokkal, céltárgy nélkül
pedig elektronsugárzással (5, 7, 9, 10, 12, 14 MeV)
végezhetjük a kezelést. A sugármezőn belüli dózishomogenitás
megfelelően kialakított szűrőkkel érhető
el. A szűrők alakja és mérete energiánként változó,
ezért a szűrőváltó mindig a választott energiához tartozó
szűrőt állítja a sugárnyaláb útjába. A tükör és a
fényforrás segítségével a sugármezővel azonos méretű
és helyű fénymező vetíthető a beteg bőrére, amely
segíti a sugármező beállítását a kezelés előtt. A főkollimátort
két pár motorikusan mozgatható, ólom blende
alkotja, amellyel a fókusztól mért 1 m távolságra
0-40 cm közötti oldalhosszúságú, mindkét irányba
90°-os szögtartományban elforgatható téglalap alakú
mezőt lehet előállítani.
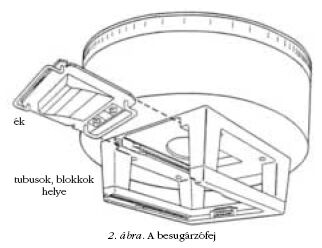
A gyorsítóhoz tartozó kiegészítő elemek: tubusok,
ékszűrők, blokkok (lásd később).
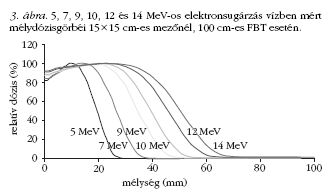
Kezelés elektronsugárzással
Az elektronsugárzást általában 5 cm-nél nem mélyebben
elhelyezkedő felszíni daganatok kezelésére alkalmazzák.
A sugárterápiában alkalmazott különböző
energiájú elektronok vízben mért mélydózisát a 3.
ábra szemlélteti.
A mélydózisgörbe három szakaszból tevődik össze.
A dózismaximumot egy "build up" (felépülési) szakasz
előzi meg, melynek mélysége (és így a felépülési
szakasz hossza is) függ az alkalmazott energiától. Ezt
követi egy meredeken csökkenő dózisesési szakasz,
amely az elektronabszorbció következménye. Végül
pedig egy, a mélységgel csak lassan csökkenő rész
következik, melynek oka a testszövetben keletkező
fékezési sugárzás (1-6%, jelentősége csak nagy besugárzási
mezők esetén van).
Az elektronnal való kezelés során az orvos az elváltozás
nagyságától függően dönt a besugárzási mező
méretéről. A gyorsító fejéhez különböző nagyságú
négyzet és kör alakú mezőt adó tubus (4. ábra) csatlakoztatható.

Mivel az elektronok a levegőben szóródnak, ezért
kezeléskor a tubus a beteg testére "rásimul", bőréhez
hozzáér. Ha a mező alakja jelentősen eltér a tubus
méretétől és alakjától, akkor az orvos ólomlemezből
különféle takarásokat készíttet a beteg számára. Szintén
a kezelőorvos feladata a célterület mélysége alapján
a sugárkezeléshez használt elektron energiájának
nagyságáról dönteni.
Kezelés fotonsugárzással
A nagyenergiájú fotonsugárzás felgyorsított elektronok
megfelelő céltárgyba történő ütközésével keletkezik.
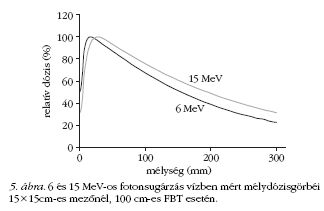
A fotonsugárzást a nagyobb áthatoló képessége és
a bőrvédelem szempontjai miatt a mélyebben elhelyezkedő
daganatos elváltozások kezelésére használjuk.
A fotonsugárzást is a mélydózisgörbék segítségével
jellemezhetjük (5. ábra).
A dózis a felszínen igen kicsi, innen a "build up"
szakaszban növekszik, majd a maximum után exponenciálisan
csökken. A maximum tehát nem a felszínen
alakul ki (6 MeV-nél 15 mm, míg 15 MeV esetén 28
mm), és a hozzá tartozó mélység az energia növelésével
nő. A relatív dózis a dózismaximumtól távolodva
csökken a mélységgel. Ugyanakkor a relatív dózis függ
a mezőmérettől is, mert annak növekedésével a sugárnyalábban
lévő szórt fotonok aránya is nő.
A besugárzás tervezéshez alapvetően szükségesek a
mélydózisgörbén kívül az izodózisgörbék is. Az izodózisgörbe
a sugárnyalábon belül egy megadott viszonyítási
ponthoz képest azonos dózisokat összekötő
vonal. Az izodózisgörbéket vízfantomban (mivel az
emberi test nagy része víz) történő méréssel lehet
meghatározni.
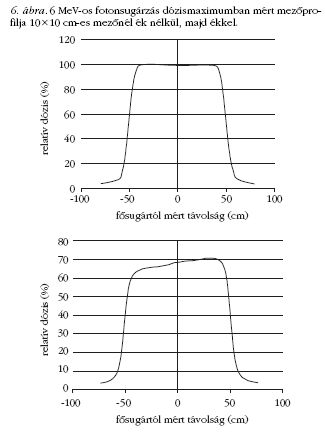
Ha például a sugármező a testfelszínre ferdén esik
be, vagy a testen belül nagy szöveti (sűrűségbeli) különbségek
vannak, akkor a homogén eloszlás eléréséhez
szokás úgynevezett ékszűrőt (lásd 2. ábra) használni.
Ez egy olyan ólomból készült, közel ék keresztmetszetű
lap, melyet a sugárforrás és a testfelszín
közé, a sugárforrás közelébe helyeznek el, a fősugárra
merőlegesen a test felszínétől olyan távolságra,
hogy az ebből kilépő másodlagos sugárzás ne érje a
bőrfelületet. Az ékszűrő a sugárnyalábon belül fokozatosan
csökkenti a dózisteljesítményt, ezért az izodózisgörbék
az ék vékony vége felé elhajlanak (6. ábra).
Leggyakrabban 15, 30, 45, vagy 60 fokos éket alkalmaznak.
(Az ék szögén a 10 cm mélyen mért izodózisgörbének
a vízszintessel bezárt szögét értjük.)
Természetesen az lenne az ideális, ha minden beteg
esetén a daganatos sejtek egységesen és homogénen
megkapnák az előírt dózist, míg a körülötte elhelyezkedő
ép szövetet egyáltalán nem érné sugárterhelés. Ennek
megvalósítása gyakorlatban lehetetlen, de minél
nagyobb mértékben való megközelítése érdekében van
szükség a körültekintő és pontos besugárzástervezésre.
Ez az orvos és a fizikus közös feladata.
A besugárzástervezés menete
Ha az orvos - a beteg beleegyezésével - a sugárterápiás
kezelés mellett dönt, akkor egy igen összetett
folyamat veszi kezdetét, amely a célterület
megjelölésétől a sugárminőség és a kezelés pontos geometriai
adatainak meghatározásáig tart.
A beteg először a lokalizálóba kerül, ahol a szimulátor
(egy speciális diagnosztikus röntgenkészülék) segítségével
meghatározzák a célterület elhelyezkedését, és
ennek megfelelően a céltérfogat magasságában készíttetik
el a tervezéshez szükséges CT axiális szeleteit. Nagyon
fontos, hogy a beteg a felvételek elkészítése közben
a leendő sugárkezelési körülményeknek megfelelően
(jól reprodukálható, stabil és lehetőleg kényelmes
pozícióban) helyezkedjen el. A beteg fektetésének mindenkori
reprodukálását a lokalizálóban és a gyorsítóknál
elhelyezett, beállítást ellenőrző lézerek biztosítják.
A CT-felvételek online módon jutnak át a tervezőrendszerbe,
a hozzá tartozó adatokkal együtt. A beteg
adatainak beadása után az orvos a CT-felvételek alapján
megadja, kitölti a tervezés alapjául szolgáló sugárfizikai
adatokat (a sugármező hosszát, besugárzási
energiát, az egyszeri, heti és az összdózist). A besugárzási
térkép elkészítéséhez ismerni kell az egyes
besugárzásimező-nagyságokhoz tartozó izodózis-eloszlásokat;
ezeket vízfantomban határozzuk meg. Az
izodózisok ismeretében kezdetben ezek kézi grafikus
összeadásával határoztuk meg az eredő dóziseloszlást.
Jelenleg a besugárzástervezésre az ország onkológiai
centrumaiban különböző besugárzástervező-rendszereket alkalmaznak.
A besugárzástervező-rendszerbe
a tervezéshez szükséges alapvető dozimetriai
adatokat méréssel határozzuk meg és a mérések alapján
adjuk be. A rendszer online-összeköttetésben van
a CT-vel. Az elváltozásról és környékéről készített CT-képek
hálózaton keresztül jutnak a munkaállomásra.
A felvételek a tervezéshez szükséges információkat
tartalmazzák: méretarány, a metszetek egymástól való
távolsága, valamint a sugárelnyelésre jellemző Hounsfield-
szám (H = 1000(µ - µw) / (µw - µa),
ahol µ, µw és µa
a lineáris elnyelési együttható a vizsgált szövetre, vízre
(water), illetve levegőre (air). Levegőre tehát H =
-1000, vízre 0, csontra pedig +3095-ig). A tervezőrendszer
a CT-felvételekkel kapott adatok alapján
kiszámolja a felvételeken lévő szövetek sűrűségét, az
elektronsűrűséget, majd a fizikus által beadott információk
(a kezeléshez alkalmazott fotonenergia, az
alkalmazott mezőméret, beadott sugárzási irányok, az
esetlegesen használt ékek, és mezősúlyozások alapján,
figyelembe véve a CT-képek által meghatározott
szöveti inhomogenitást) felhasználásával elkészíti a
dóziseloszlás térképét, ahol figyelembe veszi a szomszédos
területekről érkező szórt sugárzást is.
A tervek 3 dimenzióban is készülhetnek, ami
annyival jelent többet a különböző síkokban készült
kétdimenziós terveknél, hogy a szomszédos területek
szöveti inhomogenitási viszonyait, a szórt sugárzást is
képes figyelembe venni. Többnyire - a homogenitás
és a bőr kímélése érdekében - általában nem egy,
hanem több besugárzási mezőt alkalmazunk, és a bejelölt
tumort oly módon célozzuk meg, hogy a különböző
irányból érkező sugárnyalábok a berajzolt célterületben
találkozzanak. A tervezőrendszerek általában
alkalmasak SSD (állandó fókusz-bőr távolságú) álló,
izocentrikus álló és mozgó mezős besugárzási technikák
tervezésére és számítására.
Izocentrikus besugárzás esetén egy rögzített pont
(izocentrum), mint geometriai tengely körül a kilépő
nyaláb fősugara mindig átmegy. A forgatás különböző
hosszúságú körívek mentén lehetséges. A gyorsítócső
forgatásához tartozó forgástengely a fősugarat az izocentrumban
metszi. Ennek a módszernek az a hátránya,
hogy a lokalizálóban nehézkes az izocentrum
beállítása, viszont könnyebbséget jelent, hogy csak
egyszer kell megkeresni azt, mert a kezelés során
végig állandó. Ezt a technikát igen gyakran alkalmazzuk,
például: medence sugárkezelésénél.
Mozgó besugárzás esetén a besugárzófej a besugárzandó
Céltérfogat egy pontja, mint forgáspont (tengely)
körül fordul el, tehát ez is izocentrikus. Ennek
egyik fajtája az, amikor a sugárforrás a körnek csak
egy adott ívszakaszán mozdul el (ingabesugárzás).
Ezen technika esetén lehetőség van arra, hogy a besugárzott
körív után egy ideig ne bocsásson ki sugárnyalábot,
majd egy újabb szakaszon ismét (skip-scan
technika) és így tovább .... Lehetséges a mozgó besugárzást
folyamatosan, 360°-on keresztül alkalmazni,
ekkor a céltérfogaton belül igen homogén dózis érhető
el, azon kívül pedig rendkívül meredek dózisesés.
A mozgó besugárzási technikát általában akkor választjuk,
ha a célterület megközelítőleg ellipszis alakú,
például: tüdőtumor esetén.
Az SSD-technikát akkor célszerű használni, ha nehézkes
és valószínűleg pontatlan lenne az izocentrum
meghatározása a terv alapján. Hátránya ennek a módszernek,
hogy minden egyes mezőnél külön be kell állítania
az asszisztensnek az adott távolságot. Leggyakrabban
emlődaganat kezelése esetén alkalmazzák.
A célterületen belül, annak határán és rajta kívül is
a dóziseloszlás az alkalmazott módszertől függ. Azt,
hogy az említett technikák közül melyikkel készül egy
adott terv, többek között a célterület formájától, elhelyezkedésétől,
illetve az esetleges közelben lévő kritikus
szervek elhelyezkedésétől függ. Minden mezőhöz
külön kell kiválasztani a használni kívánt energia
nagyságát, így egy tervben akár többféle sugárminőség
is előfordulhat az adott szituációtól függően.
Az egyes mezők mérete lehet eltérő: 1x1 cm-től
40x40 cm-ig változhat 1 mm-es léptékben. A gantry
és a kollimátor szöge tetszőlegesen 1°-onként elforgatható
mindkét irányba. Az utóbbi segítségével állítható
be a sugármező alakja és nagysága is. Különböző
energia-, tehát dózismódosító eszközök használhatók,
ugyanakkor bármelyik mező esetén lehet éket és
blokkot is alkalmazni. Az éknek a különböző szöveti
inhomogenitások (sűrűség, energiaelnyelés), illetve a
testkontúr változásainak kompenzálásában van szerepe.
Általában mindig a keskenyebb végével fordítjuk
oda, ahol növelni szeretnénk a dózist a többi területéhez
képest. Használhatók általában 15, 30, 45 és 60°-
os ékek egymáshoz képest 180°-kal elforgatott állásban.
Blokkokat akkor alkalmazunk, ha a sugármező
egy részének kitakarása szükséges. Ezek a blokkok
úgynevezett Newton-fémből (50% bizmutot, 31,25%
ólmot és 18,25% ónt tartalmaz) készülnek és lehetőség
van a fizikus által kiválasztott tetszőleges alakúra
önteni (ez a technikus feladata).
A tervezés fontos fázisa a besugárzási terv optimalizációja.
A célterületet magába foglaló izodózisgörbét
(amely legrosszabb esetben is 85%-os görbe) 100%-nak
véve normalizáljuk az eloszlást. Ennek megfelelően adjuk
meg a napi dózis nagyságát és számolja ki a rendszer
az egyes mezőkhöz tartozó monitoregységet (a
gyorsító úgy van kalibrálva, hogy normál körülmények
között, az adott energiánál, 100 cm-es FBT és 10x10
cm-es mező esetén a vízben mért dózismaximumban
100 MU (1 MU (monitoregység) = 1 gray).
Ha az elkészült terv és a számítógép által kiszámolt
és berajzolt izodózisgörbék megfelelnek a kívánalmaknak,
akkor az adott szint CT-metszetére készült
terv (esetleg más síkok is) kinyomtatásra kerül a gyorsító
beállításához, a kezeléshez szükséges adatokat
tartalmazó protokollal együtt. Ennek alapján kezdődhet
meg a sugárkezelés.
A daganatos megbetegedések a leggyakoribb, vezető
halálokok között, a második helyen állnak, és a
halálozások számán belüli arányuk fokozatos emelkedést
mutat. A gyógyítás egyik eszköze az ionizáló sugárzások
(pl. elektron- vagy fotonsugárzás) alkalmazása.
Ennek során az orvossal együttműködő fizikusnak
is fontos szerepe van.
Irodalom
Gyenes Gy., Németh Gy., Sugárterápia. Medicina Könyvkiadó Rt.,
Budapest, 1997.
Horváth F., Az orvosi radiológia aktuális kérdései. 8918806 MTA
Sokszorosító, Budapest, 1989.
Rodé I., Klinikai Onkoradiológia. Medicina Könyvkiadó Rt., Budapest,
1984.
Helax-TMS System Reference Manual 4.0. Helax AB, 1997.
Horváth F., A radiológia alapfogalmai. Medicina Könyvkiadó Rt.,
Budapest, 1994.
Kásler M., Az onkoterápia irányelvei. B+V Lap- és Könyvkiadó Kft.,
2001.
Köteles Gy., Sugáregészségtan. Medicina Könyvkiadó Rt., Budapest,
2002.
Németh Gy., Sugárterápia. Springer Tudományos Kiadó Kft., 2001.
A témához kapcsolódik egy - fizikus körökben sokak
által ismert - történet Szilárd Leóról, mint a sugárterápia
önkéntes úttörőjéről: 1960-ban megállapították,
hogy húgyhólyag rákja van. Az akkoriban
lehetséges gyógymódok tanulmányozása után sugárterápiát
kért orvosaitól. (A híres New York Memorial
Hospitalban kezelték.) A terápiát maga tervezte meg,
az általa meghatározott dózisnak megfelelő, sugárzó
ezüstöt operáltatott magába. Ezt két év múlva, 1962-
ben megismételték.
Nem ismert, hogy milyen egyéb kezelést kapott,
ezért nehezen értékelhető a "sugárterápia" sikeressége.
(Szilárd 1964-ben halt meg, szívinfarktusban.) A
történetben az azt ismertető források egy része inkább
Szilárd kissé excentrikus természetének illusztrációját
látja.
__________________________________
Jelen cikk alapjátaz egyik szerző (B. É.) Besugárzás-tervezés és
kiértékelés című szakdolgozata képezi (Debreceni Egyetem, Természettudományi
Kar, Kísérleti Fizikai Tanszék, 2006), amelynek teljes
anyaga megtalálható a Tanszék honlapján:
http://fizika.ttk.unideb.hu/kisfiz/harsanyi/Public/diplomamunkak.htm.
