Fizikai Szemle honlap |
Tartalomjegyzék |
Keszthelyi Lajos
MTA Szegedi Biológiai Központja
1. Bevezetés
A Halobaktérium halobium sejtmembránjában található bakteriorodopszin (bR) molekulák fény hatására protont juttatnak ki a sejt belsejéből a külső térbe [1]. A folyamat fényenergia átalakítása elektrokémiai energiává, minthogy a proton transzlokáció membránpotenciált (![]() ) és pH különbséget (
) és pH különbséget (![]() ) hoz létre. A sejtek az elektrokémiai energiát ATP szintézisre használják fel.
) hoz létre. A sejtek az elektrokémiai energiát ATP szintézisre használják fel.
Minthogy a proton transzlokáció jelensége mai ismereteink szerint teljesen általános a membránhoz kötött energiatermelő folyamatokban [2], a mechanizmus megismerése lényeges feladat. A mitokondriális és a fotoszintézishez kapcsolt folyamatok nagyon bonyolultak a bR-hez képest, ezért a lényeges ismeretek megszerzése az egyszerűbb esetben több sikerrel várható.
Csoportunk mintegy 10 éve foglalkozik a bR működésével. Az eredmények közül itt azokat emeljük ki, amelyek kisérleti adatokat szolgáltatnak a proton transzlokáció mechanizmusára vonatkozóan ([3-6] összefoglaló dolgozatok).
2. Előzmények
A bR molekulában a fehérje részhez egy retinál molekula kapcsolódik protonált Schiff- bázis révén. Foton gerjesztés hatására abszorpció változásokkal kisért ciklus indul el, amelyben legalább öt közbülső állapotot lehet megkülönböztetni az abszorpciós maximumok és időállandók alapján [1].
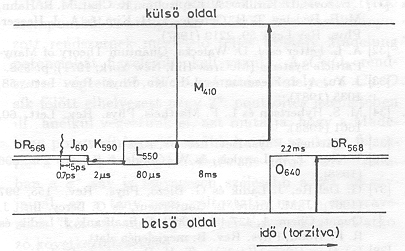
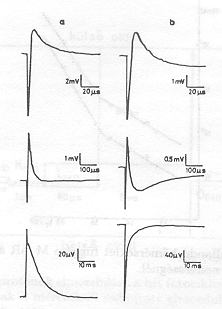
A csoportunkban kidolgozott módszerekkel sikerült kimutatnunk, hogy a közbülső állapotokhoz vezető változások időállandóit elektromos jelek időállandóiban is megtaláljuk [3-6]. Az elektromos jeleket orientált bR-mintákban a töltések mozgása révén keltett eltolási áramok hozzák létre. Feltesszük, hogy a bR-ben a mozgó töltés proton és a bR homogén dielektriknm. Ily módon az egyes lépésekhez tartozó töltéselmozdnlás nagyságát (di) a mért elektromos jelek területe (![]() a jel maximális amplitudója,
a jel maximális amplitudója, ![]() : a jel időállandója) alapján meg lehet határozni. Az egyes átmenetekhez tartozó di értékeket az 1. ábrán grafikusan mutatjuk be. Látható, hogy a protonok mozgásában két "hosszú" komponens van: d4 = 3,1 nm az M-O átmenethez, d5 = 1, 5 nm az O-bR átmenethez tartozik.
: a jel időállandója) alapján meg lehet határozni. Az egyes átmenetekhez tartozó di értékeket az 1. ábrán grafikusan mutatjuk be. Látható, hogy a protonok mozgásában két "hosszú" komponens van: d4 = 3,1 nm az M-O átmenethez, d5 = 1, 5 nm az O-bR átmenethez tartozik.
Lényeges megérteni azt, hogy milyen mechanizmussal teszik meg a protonok ezt a nagy távolságot a fehérjében. A legismertebb hipotézis Nagle és társaitól származik [7]: a bR-ben lévő egyes aminosavak oldalláncaiból ún. hidrogén kötés lánc építhető fel, amely a jéghez hasonlít. A proton vezetés a láncon - amelyet proton vezető drótnak is neveznek - úgy folyik le, mint a jégben. Először a proton mozog, aztán a hibahely. Az utóbbihoz bizonyos flexibilitás szükséges, mert a H-O-H csoportnak egy tengely körül el kell fordulnia. A hipotézis részletes kifejtése a [8] dolgozatban található.
Célul tűztük ki, hogy kisérleti adatokat nyerjünk a hipotézissel kapcsolatban. Elektromos jeleket vizsgáltunk olyan esetekben, amikor
A mérési adatok alapján - bár a proton vezető drót hipotézist nem sikerült teljes mértékben kizárni - egy új hipotézist dolgoztunk ki, amely a proton transzlokációt lényegesen egyszerűbben értelmezi.
3. Mérési eredmények
A bR molekulákat a baktériumokból az ún. bíbor membránban (purple membrane, pm) koncentrálva állítjuk elő. A pm csak bR-t és lipidet tartalmaz, átmérője ~ 500 nm, vastagsága 5 nm. Elektromos térben (kb. 10-15 V/cm) szuszpenzióban orientálható, mert viszonylag nagy permanens elektromos dipólmomentuma van. Az orientált pm-ek gélben [9], vagy egy felületre lecsapatva rögzíthetők [10]. Ilyen módon három különböző tipusú orientált mintát készíthetünk, amelyek különböző jellegű mérésekre alkalmasak.
3.1. Környezeti tényezők
3.1.1. pH-függés
A proton vezető drót tulajdonságai - tekintve, hogy proton donor és akceptor tulajdonságokkal rendelkező oldalláncok az összetevői - nyilvánvalóan függenek az oldat pH-jától. Proton donorként COOH, akceptorként NH2 csoportokkal rendelkező aminosavak (aszparaginsav, glutaminsav, illetve lizin, arginin, tirozin) szolgálhatnak. Érdemesnek látszott tehát az elektromos jelek pH-függését tanulmányozni. A vizsgálatokra a szuszpenzióban elektromos térrel orientált minta látszott célszerűnek, mert ebben a pH gyorsan és egyenletesen változtatható.
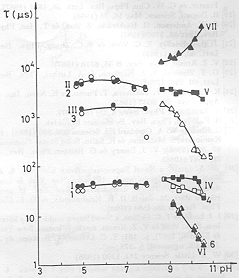
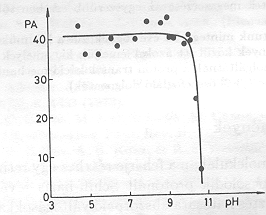
A mérések egy részében összehasonlítottuk az elektromos és fényabszorpciós jelek élettartamát (2. ábra). Megállapítható, hogy az 5-8 pH tartományban a koincidencia kielégítő, pH=8 felett az elektromos jelek gyorsabbá válnak az optikaiaknál [11]. Úgy tűnt, hogy nagy pH-n az optikai és az elektromos jelek szétkapcsolódnak. Fontos volt megfigyelni, hogy ezeknek a változásoknak ellenére PA-banl pH=10,5-ig nem következett be változás (3. ábra), jóllehet a tirozin, lizin és arginin oldalláncok protonáltsága e tartományban változik [12].
3.1.2. A nedvesség hatása
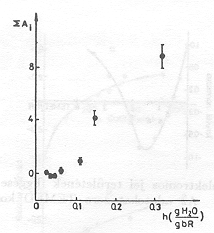
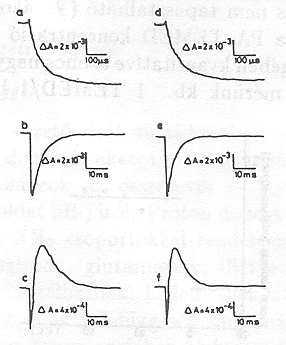
Átlátszó elektródon felületre orientálva lecsapatott pm-ek esetében a minta nedvességtartama egyszerűen változtatható [10]. Kimutattuk, hogy PA=0, ha a nedvesség kisebb, mint 0,06 g H2O/g bR. Proton transzlokáció tehát nem következik be, az elektromos jelek a fehérjén belül odavissza mozgást jeleznek. A 4. ábra adatai mutatják, hogy a PA növekszik a fenti értéknél nagyobb nedvességeken, mutatva, hogy a proton pumpa működéséhez adott mennyiségű H2O molekula elengedhetetlenül szükséges. A jelenséget részletesen is vizsgáltuk. Különböző nedvességeken a hőmérséklet változtatásával meghatároztuk az időállandót leíró Arrhenius függvény
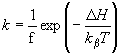
két paraméterének ( f = a frequencia faktor és ![]() az aktivációs entalpia) nedvesség függését. Az 5. ábra tartalmazza az adatokat a bR fotociklusának különböző átmenetei esetén. A közös jellemző az, hogy mind 1/f, mind
az aktivációs entalpia) nedvesség függését. Az 5. ábra tartalmazza az adatokat a bR fotociklusának különböző átmenetei esetén. A közös jellemző az, hogy mind 1/f, mind ![]() ugrásszerűen változik a 0,06 g H2O/g bR nedvesség értéknél [13].
ugrásszerűen változik a 0,06 g H2O/g bR nedvesség értéknél [13].
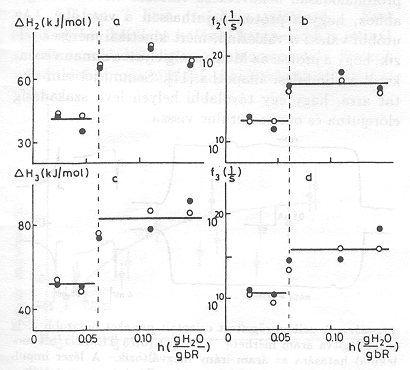
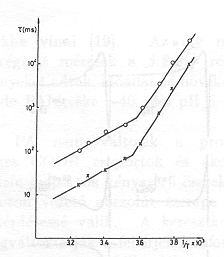
Fontos megjegyezni, hogy a küszöbértéknél nagyobb nedvességnél (pl. 0,1 g H2O/g bR értéknél) az Arrhenius paraméterek értéke különbözik 0 C° alatt és felett (6. ábra), PA értéke 0 C° alatt zéro és csak 0 C° felett [13] mutat proton transzlokációra valló pozitív értéket (7. ábra.)
Ezek a kisérletek azt mutatják, hogy proton transzlokáció csak a küszöbértéknél nagyobb mennyiségű, folyékony állapotban levő H2O jelenlétében lehetséges. A küszöbérték átlépésénél lényeges konformáció változások következnek be, amelyeket az Arrhenius paraméterek ugrásszerű változása jelez. Megemlítjük, hogy a konformáció változást a fehérje amid sávjain jellemző infravörös rezgések intenzitásának élénk változása is kiséri [14].
3.1.3. Diaminok hatása
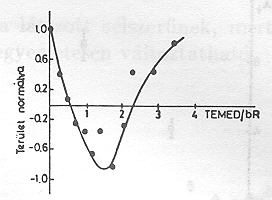
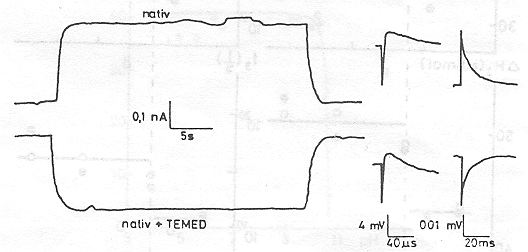
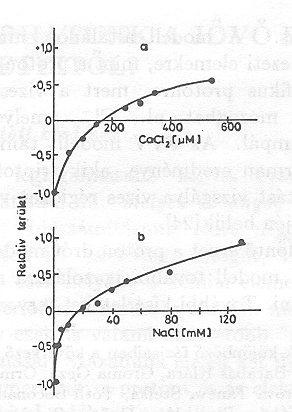
A pm-eket tartalmazó szuszpenzióhoz diaminokat adva meglepő jelenséget észleltünk [15]. A 8. ábrán az N,N,N`,N`- tetraetilmetiléndiamine (TEMED) jelenlétében végzett mérések eredménye látható összehasonlítva a natív mintán kapott görbékkel. Világosan látható, hogy a PA jelentős részét kitevő, nagy élettartamú elektromos jelek pozitív helyett negatív amplitudóval jelentkeznek. A fényabszorpciós jelekben változás nem tapasztalható (9. ábra.) Amint a 10. ábrán a PA TEMED koncentráció függése mutatja, lényegében kvantitatíve azonos nagyságú, de negatív PA-t mérünk kb. 1 TEMED/1 bR molekula esetén, mint anélkül. A jelenség még határozottabban látszik a 11. ábrán, ahol folyamatos áram folyik egyik és másik irányban, azonos nagyságban kb. 30 másodpercig tartó folyamatos megvilágítás során
A TEMED hatására kialakuló negatív elektromos jelek konzekvens értelmezése az, hogy a proton transzlokáció iránya megváltozik, a proton pumpa fordított irányban működik. Valószínű, hogy a hatást a TEMED pozitív töltése idézi elő, amikor a membrán vagy a fehérje alkalmas részeihez hozzátapad. Két kötőhely van a membrán két oldalán különböző affinitással. Az első, a nagyobb affinitású megbontja az eredeti töltéseloszlást és megfordítja a pumpát, a másik hely, a másik oldalon visszaállítja azt, és akkor visszaáll az eredeti pumpa irány is. A TEMED tapadását meg lehet szüntetni ismételt mosással, vagy, ha különböző sókat adunk az oldathoz (12 a, b. ábra)
Értelmezésünk szerint a kisérleti eredmények azt mutatják, hogy a membrán felületén lévő, vagy a bR felszínén található töltéseknek lényeges szerepük van a transzlokáció irányának a meghatározásában.
3.2 Kémiai módosítások
Az aminosavak oldalláncait különböző kémiai eljárásokkal módosítani lehet; pl. a tirozinokat jódozni, a COOH-csoportokat, a lizin csoportokat keresztkötésekkel módosítani. Lehetőség van továbbá arra is; hogy különböző enzimekkel a bR membránból kilógó részeit leemésszük, vagy a hélixek közötti folyamatos kötést szétvágjuk. Az így előállított mintákon végzett mérések is értékes tapasztalatokat nyújtanak a proton transzlokáció mechanizmusára vonatkozóan.
3.2.1. Tirozinok jódozása
A tirozin oldalláncoknál a H-atomot viszonylag könnyű I atomra kicserélni kémiai módszerekkel [17]. Az eljárás során nem határozható meg, hogy a fehérjén belül melyik tirozin változik. A jódozott mintán vizsgálva az elektromos jelet, azt kapjuk, hogy a PA erősen lecsökken, a pH függvényében, mintegy 20 %-a lesz a natív bR esetében mért értéknek (13. ábra, [18]). A tirozin jódozása tehát befolyásolja a proton transzlokációt. A kérdés csak az, hogy vajon az ok a proton vezető megszakadása, vagy az, hogy egy tirozin protonálódásán bekövetkező változás eleve szükséges ahhoz, hogy a proton bejuthasson a vezetőbe. Az utóbbi válasz a valószínű, mert kinetikai mérések jelzik, hogy a proton az M állapotig eljutva onnan visszakerül a kiindulási állapotba [17]. Semmi jel sem mutat arra, hogy egy távolabbi helyen levő szakadásig előrejutna és onnan kerülne vissza.
3.2.2. Karboxil csoportok keresztkötése
Két kémiai reagenst használtunk arra, hogy a karboxil csoportok a szén atomját és lizinek ![]() -amino csoportját összekösse. 1-etil-3 (3-dimetilaminopropil) carbodiimide (EDC) vízben oldódó és N-etoxikarbonil-2-etoxi-l,2-dihidrokvinolin (EEDQ) lipidben oldódó keresztkötő ágens. EDC tehát a pm-ből kilógó, EEDQ a pm-ben, a fehérje belsejében levő csoportokat kapcsolja össze.
-amino csoportját összekösse. 1-etil-3 (3-dimetilaminopropil) carbodiimide (EDC) vízben oldódó és N-etoxikarbonil-2-etoxi-l,2-dihidrokvinolin (EEDQ) lipidben oldódó keresztkötő ágens. EDC tehát a pm-ből kilógó, EEDQ a pm-ben, a fehérje belsejében levő csoportokat kapcsolja össze.
Az elektromos és optikai mérések azt mutatták, hogy a fotociklus időállandói lényegesen megnőttek, az M forma alakulásában kettő és bomlásában három komponens jelentkezett mindkét ágens esetében [18]. A változások nem
mutatkoznak azonban meg a PA értékekben: PA (EDC) = 39  4, PA (EEDQ) = 44
4, PA (EEDQ) = 44  4.
4.
3.2.3. Lizinek kereszkötése
A bR-ben 7 lizin molekula található. Ezek közül egyhez kovalens kötéssel kapcsolódik a retinál, a fennmaradó hat lizin ![]() -aminocsoportját dimetil-3,3'-dithiobispropionimidat dihidrokloriddal lehetett keresztkötésekbe vinni [19]. Az így módosított mintákon elvégzett mérések a 3.2.2. részhez hasonló eredményeket adtak; időállandó növekedés, több komponens, de PA értéke ~40 volt pH 5-10 között [19].
-aminocsoportját dimetil-3,3'-dithiobispropionimidat dihidrokloriddal lehetett keresztkötésekbe vinni [19]. Az így módosított mintákon elvégzett mérések a 3.2.2. részhez hasonló eredményeket adtak; időállandó növekedés, több komponens, de PA értéke ~40 volt pH 5-10 között [19].
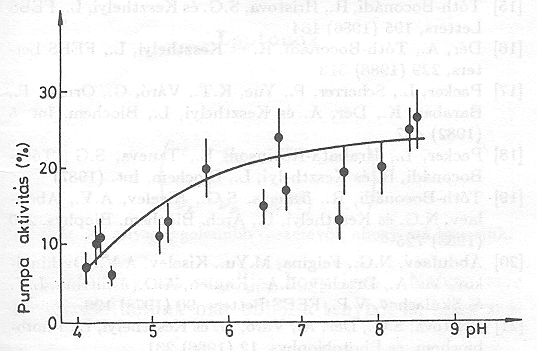
Minthogy PA nem változik a protondonorként szükséges COOH csoportok és akceptorként szolgálható lizin csoportok kényszerű összekapcsolása esetén, a proton vezető abszolút szerepe a transzlokációban kérdésessé válik. A keresztkötések bizonyosan megváltoztatják a fehérjék konformációját, ezek következménye az időállandók megváltozása. Mondhatjuk, hogy a keresztkötés lelassítja a proton transzlokáció folyamatát, de azt nem gátolja.
3.2.4. Protein emésztés
A bR molekulák karboxil végét (17 aminosavmolekula) emészthetjük el, vághatjuk le tripszin enzimmel és kis koncentrációjú (1:200 (W/W) papain/bR) papainnal. 1:20 és 1:2 papain koncentráció esetén a láncot vágjuk el a 3. és 4. hélix között, ilyenkor a fehérje a membránban két különálló peptidet tartalmaz [20].
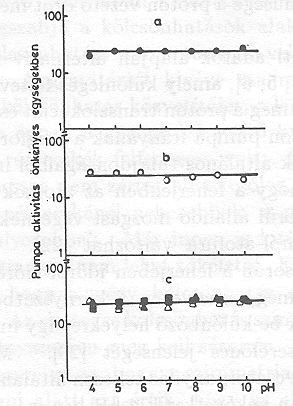
A különböző emésztések hatására az időállandók némileg változtak, de a pumpa aktivitása nem változott [21]. A 14. ábrán mutatjuk be az eredményeket, nyílvánvaló, hogy az emésztés nem változtatja meg a PA értékét nagyon széles pH tartományban.
Ez a vizsgálatsorozat arra mutat rá, hogy a bR molekula a proton pumpálás szempontjából többé-kevésbé redundáns, mert elvehetünk 17 aminosavat a molekulából és utána még ketté is vághatjuk, a protonpumpa aktivitása nem változik meg lényegesen. Úgy tűnik, hogy a fehérje bizonyos általános tulajdonságai szükségesek a proton transzlokációhoz, amelyeket nem zavarnak meg a fehérjében bekövetkező fenti változások.
4. A proton transzlokáció mechanizmusa
A kísérleti adatok nem kedveznek a proton vezető drót hipotézisnek. A pH-függés, a nedvesség függés, a donor-akceptor szerepre jelölt oldalláncok kémiai befolyásolása arra mutat, hogy a hipotézis csak nehézségek árán tartható. A szükséges további feltevések:
a) a jelölt oldalláncok protonálódásának pH függése a fehérjén belül egészen más, mint oldatban; b) a proton vezető drót esetleg .hiányhelyeket tartalmaz, amelyeket vízmolekulákkal kell betölteni; c) kellő mennyiségű folyékony víz hiányában a fehérje nem elég flexibilis ahhoz, hogy a szükséges rotációs mozgások létrejöhessenek. A feltevéseket nem zárhatjuk ki, és mindaddig nem vethetjük el véglegesen a hipotézist, amíg a fenti kísérleteken túlmutató adatok nem állnak rendelkezésre. A legfontosabb legbiztosabb érv a bR háromdimenziós 1-2 Ĺ felbontású szerkezete lenne, amely pontosan megadhatná a szükséges oldalláncok geometriai helyzetét. Sajnos, ilyen adatok egyenlőre nincsenek. Ma csak azt mondhatjuk, hogy nagyon kicsi a valószínűsége a proton vezető drót mechanizmusnak.
A kísérleti adatok alapján alternatív modellt javasoltunk [4, 5, 6], amely különleges feltevések nélkül magyarázza meg a proton transzlokációt és értelmezni tudja a proton pumpa irányának a megfordulását is.
A fehérjék általános tulajdonságaiból indulunk ki. Ismeretes, hogy a fehérjékben az atomok egyensúlyi helyzetük körül állandó mozgást végeznek. Az amplitudó atomról-atomra változhat [22]. A véletlen fluktuációk során a fehérjében időről-időre csatornák nyílhatnak meg, amelyeken a környezetből vízmolekulák jutnak be különböző helyekre. Így magyarázzák a H-O kicserélődés jelenségét [23]. Minthogy a fluktuáció, a csatornanyílás teljesen általános jelenség, nyílvánvalóan bekövetkezik a bR-ben is.
A proton az M állapotban kb. 0,5 nm-re előre jutva egy COO- csoporthoz kötve van, ebből nem tud előre menni, csak nagyon hosszú időállandóval visszafelé, ha nincs elég H2O jelen. Ez magyarázza PA zéro értékét kis víz koncentrációnál. Elegendő folyékony H2O jelenlétében a fluktuációk során nyíló csatornákon H2O molekulák jutnak a kötött proton közelébe, a barriert lecsökkentik, a proton a vizes csatornába jut, ![]() O ion keletkezik, amelyet a fehérjében ható elektromos tér a felszínre továbbít. Az elektromos tér két forrásból származik: a fény hatására töltésszétválás lép fel a fehérjén belül (fényindukált komponens), és a fehérjében és a felületen levő töltések tere (meglévő komponens). Az utóbbit befolyásolja a TEMED, ezzel megváltoztatja a két tér eredőjének az irányát.
O ion keletkezik, amelyet a fehérjében ható elektromos tér a felszínre továbbít. Az elektromos tér két forrásból származik: a fény hatására töltésszétválás lép fel a fehérjén belül (fényindukált komponens), és a fehérjében és a felületen levő töltések tere (meglévő komponens). Az utóbbit befolyásolja a TEMED, ezzel megváltoztatja a két tér eredőjének az irányát.
Modellünk, amelyet nevezhetünk folyékony víz vezető modellnek (FVV), értelmezni tudja a legkritikusabb kísérleti adatokat: nedvesség függés, TEMED hatás. A modell általános, nincs szüksége olyan szerkezeti elemekre, mint a proton vezető drót. Nem specifikus protonra, mert a vizes csatornába más ion is mozoghat, pl. Cl-, amelyet a halorodopszin pumpál. Az FVV modellt támogatja Plotkin és Sherman eredménye, akik triptofán fluoreszcencia kioltást vizsgálva vizes régiókat valószínűsítenek a fehérjén belül [24].
Igazán döntő érvet a proton drót modell elvetésére és az FVV modell további igazolására még nem sikerült találni. További kísérleteket tervezünk.
A munkák különböző fázisaiban a következő munkatársaim vettek részt: Barabás Klára, Groma Géza, Ormos Pál, Száraz Sándor, Hristova Taneva Stefka, Tóth-Boconádi Rudolf, Dér András, Dancsházy Zsolt, Váró György, Zimányi László.
A munka egyes részei nemzetközi kooperációban folytak. A résztvevők: L. Packer, P. Scherrer, K.T. Yue, E. Hrabeta-Robinson, A.V. Kiselev, N.G. Abdulaev.
Minden közremüködőnek hálás köszönetemet fejezem ki.
IRODALOM
_________________________
1 Célszerű bevezetni a pumpa aktivitás (PA) fogalmát: PA = -![]() , tehát a teljes területet osztjuk az első negatív jel területével, amely arányos a proton transzlokációban résztvevő bR molekulák számával. Natív orientált pm-ek esetében a numerikus érték PA = 40 ± 2.
, tehát a teljes területet osztjuk az első negatív jel területével, amely arányos a proton transzlokációban résztvevő bR molekulák számával. Natív orientált pm-ek esetében a numerikus érték PA = 40 ± 2.
_________________________
Akadémiai székfoglaló, 1988. október 10.