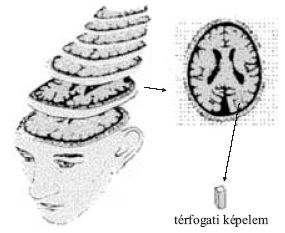
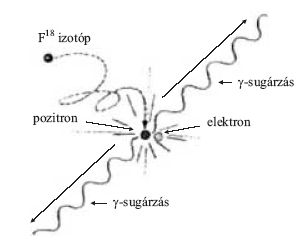
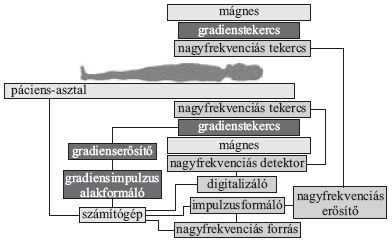
1. ábra. Egy háromdimenziós testet különböző irányokból nézve más és más alakot látunk. A valódi háromdimenziós alakot csak sok irányból felvett képek alapján tudjuk rekonstruálni.
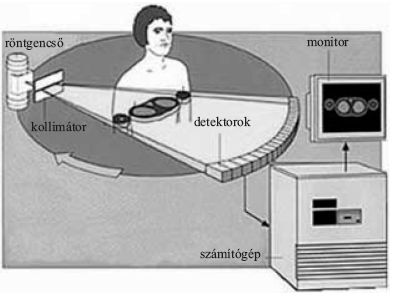
2. ábra. Röntgentomografikus mérési elrendezés vázlata. A pontszerű forrásból kiinduló sugarak a testen keresztülhaladva és egy részük elnyelődve érkeznek a detektorokba. A minden irányban mért intenzitáseloszlásból vissza tudunk következtetni egy szelet anyageloszlására.