
1.ábra. A céltérfogat, a gerincvelő és a sugármező vetülete a sugárforrás egyik nézőpontjából (+90)
Fizikai Szemle honlap |
Tartalomjegyzék |
Ésik Olga
Országos Onkológiai Intézet
Németh György
Haynal Imre
Egészségtudományi Egyetem
A rosszindulatú daganatok oki gyógykezelésére ez idő szerint három alapvető eljárást alkalmazunk. Ezek a sebészet, a sugárterápia (külső irradiáció, illetve a radioizotópok), valamint a kemoterápia (daganatgátló gyógyszerek). A sebészet és a külső sugárterápia helyi gyógymódok, a daganatkezelés szempontjából távolhatásuk nincs. Ezzel szemben a vérkeringésbe juttatott radioizotópok és a kemoterápeutikumok az egész testre fejtenek ki hatást. Erre akkor van szükség, ha a szervezetben szétszóródott daganatsejteket kell felkeresni és elpusztítani.
A három kezelési módszer jellemzésén túl azok arányára is ki kell térni. A rosszindulatú daganatok kórlefolyása során a betegeken - rendkívül kevés kivételtől eltekintve - valamilyen sebészeti beavatkozást végrehajtanak. Ez a két véglet - a radikális műtét és a kórisme bizonyítása érdekében végzett szövettani mintavétel - között bármi lehet. A betegek mintegy kétharmadának van szüksége külső sugárterápiára. Radioizotóp-kezelések egyelőre kevesebb mint az esetek 1 %-ában alkalmazhatók. Kemoterápiára a kórlefolyás során hozzávetőlegesen 50 %-ban lehet szükség.
A daganat biológiai sajátosságai és a kórismézés idején bizonyítható anatómiai kiterjedése határozza meg a választandó kezelési módozatokat és azok alkalmazásának sorrendjét. Ez azt jelenti, hogy a sugárkezelés nem “súlyosabb" terápiás módszer mint a másik kettő. Sőt, általánosságban azt lehet mondani, hogy többnyire korai, távoli áttétképződéssel nem járó daganatra utal az, ha elsődleges kezelésként - kemoterápia nélkül - a sebészet és sugárkezelés választható.
A külső sugárkezelésnek két formája van: a tele- és a brachyterápia. Az előzőnél a beteget a bőrön keresztül sugarazzuk be (telekobaltágyúval, újabban főleg lineáris gyorsítóval). Közelbesugárzásnál (brachyterápiánál) a tumorba vagy a daganatos testüregbe helyezzük a sugárzó anyagot, ami a dózisnak a távolsággal való gyors csökkenése következtében csak a közvetlen környezetben fejti ki hatását.
A besugárzástervezés pontossága és a sugárterápia kivitelezésének színvonala meghatározza a külső irradiáció eredményességét, így a betegek gyógyulási esélyeit. A sugárterápia során egy adott céltérfogat (daganat + biztonsági zóna) meghatározott sugárdózist kap. A kezeléstől elvárjuk, hogy a környező normális szöveteket minimális sugárhatás érje. A végső cél a daganat elpusztítása a kezelési mellékhatásokat az ésszerűség határain belül tartva.
Pajzsmirigydaganatok teleterápiás sugárkezelése
Pajzsmirigydaganatok esetében - néhány ritka szövettani típus kivételével - radikális műtét indikált. Ezt követően a daganatágyban, illetve a tájéki nyirokcsomókban esetlegesen visszamaradó, többnyire mikroszkopikus méretű tumorsejtek elpusztítása érdekében sugárkezelést alkalmazunk (külső irradiáció, illetve radioizotópok).
A Fizikai Szemle jelen számának célkitűzései és a pajzsmirigydaganatok különleges biológiai sajátosságai miatt választottuk klinikai példaként e tumorokat a teleterápiás besugárzástervezés fejlődésének bemutatására.
Biológiai szempontból a pajzsmirigytumorok különös érdekessége, hogy közöttük van az emberi szervezet két legszélsőségesebb daganattípusa. Az egyik a jól differenciált papilláris rák, melynek tüdőáttéteivel a beteg kisgyermekkorától kezdve együtt élhet, vele gyermekeket szülhet, s várható élettartamát számottevően nem csökkenti. Mindent el kell követni annak érdekében, hogy a beteg az adekvát terápiát megkapja, hiszen csak így alakulhatnak kedvezően az életkilátásai. A másik véglet az anaplasticus (rosszul differenciált) rák, amely a szervezet legagresszívebb tumora, s a kórisme többnyire egy éven belül bekövetkező halált jelent. E daganatok esetében azonban fel kell adni a korábbi nihilisztikus szemléletet, s olyan új utakat kell keresni, melyekkel a betegek minőségileg elfogadható élettartama meghosszabbítható.
A pajzsmirigytumorok mintegy kétharmadát kitevő papilláris rákok egy részének keletkezésében az ionizáló sugárzás különböző típusainak bizonyítottan szerepe van. A papilláris tumorok általában a sugárzás után mintegy tíz évvel kezdődően halmozódnak. A daganatkeletkezésnek nincs küszöbdózisa, vagy ha igen, az kevesebb mint 0,06 Gy (gray = J/kg). A dózis-hatás összefüggés 20 Gy-ig lineáris. E fölötti dózistartományban a daganat kialakulásának kockázata csekély, mert jelentős sugárdózis hatására a pajzsmirigysejtekben olyan végletes károsodások alakulnak ki, melyek nem teszik lehetővé a daganatos burjánzást. Egyelőre nincs elfogadható magyarázat a sugárhatás konformizmusára, azaz arra, hogy az irradiáció hatására miért keletkezik azonos szövettani típusú rák.
A papilláris tumorok incidenciájának emelkedését figyelték meg a pajzsmirigy környékén levő jóindulatú elváltozások gyermekkori sugárkezelését követően (például csecsemőmirigy megnagyobbodása, a garatgyűrű nyirokszövetének túltengése, pattanásos arcbőr stb.). A Hiroshimára ledobott urániumbomba (gamma- és neutronsugárzás), valamint a Nagaszakit sújtó plutóniumbomba (döntően gammasugárzás) következményeként a túlélő exponált népesség (20000 fő) 0,2 %-ában alakult ki pajzsmirigydaganat. A Marshall-szigeteken történt radioaktív kihullás után eddig az érintettek 1,3 %-ánál (3/229) jelentkezett pajzsmirigyrák. A csernobili reaktorbaleset után kivételesen hamar, már 4 év múltán, főleg a fiatal korosztályban figyelték meg a papilláris rákok halmozott jelentkezését (Baverstock és mtsai). A balesetet követő évben a hazai lakosságot csak a szokásos háttérsugárzás 10-20 %-ának megfelelő sugárzástöbblet érte (Sztanyik).
Az aktuális (1993-as) magyarországi pajzsmirigydaganaton morbiditás felmérése folyamatban van.
Sugárbiztonsági szempontból az elmondottak alapján két lényeges következtetés adódik. Szakmailag elfogadhatatlan a jóindulatú (nem daganatos) elváltozások ionizáló sugárzással történő kezelése. Különösen érvényes ez a megállapítás a fiatal korosztályra. Másrészt minden eszközt igénybe kell venni a háttérsugárzás emelkedésének megelőzése érdekében. A pajzsmirigydaganatok kezelésének nagy paradoxona az, hogy az ionizáló sugárzások daganatkeltő hatása ellenére, ezeket az eszközöket is felhasználjuk a gyógyításban, így a radioizotópokat (131I és 131I-MIBG = meta jodo-benzil guanidin), valamint a teleterápia eszközeit. Erre az ad lehetőséget, hogy a terápiás dózis 50-60 Gy külső besugárzás esetében, illetve az 500-600 Gy-t is eléri radiojód alkalmazásakor az előzőekben ismertetett dózis-hatás összefüggés értelmében ebben a dózistartományban már nem érvényesül a sugárzás daganatkeltő effektusa.
A pajzsmirigydaganatok sugárkezelése során bonyolult geometriai alakzatot kell besugarazni. A választandó céltérfogat alakját mindenkor az adott daganat várható helyi és nyirokrendszeri terjedése határozza meg. Ez pajzsmirigytumorok esetében patkó formájú nyaki céltérfogatot jelent, melyhez a daganat további nyirokrendszeri terjedésétől függően egy henger alakú gáton rész is csatlakozhat. A konkáv alakzat besugárzása - a hozzá kapcsolódó gáton rész nélkül is - a sugárterápia talán legnehezebben megoldható feladata. (A klinikai gyakorlatban a konkáv kifejezést használjuk arra a céltérfogatra, melynek kontúrja valamely irányból tekintve konkáv alakú.)
Tovább nehezíti a helyzetet, hogy sugárzásra különösen érzékeny, úgynevezett kritikus szervek helyezkednek el a közelben (gerincvelő, tüdő, gége). Problémát jelent az is, hogy a céltérfogat egy része a gerincvelőt részlegesen körülöleli. A kritikus szervek sugárkárosodása maradandó következményekkel járhat, ezért mindenképpen el kell érni azt, hogy sugárterhelésük a megengedett érték alatt maradjon.
A testkontúr számottevően változik a nyak és a mellkasbemenet területén. Ez a dóziseloszlás inhomogenitásának kialakulására vezethet, amit megfelelő módszerekkel kompenzálni szükséges.
Kétdimenziós (2D) besugárzástervezés
A besugárzástervezés hosszú időn keresztül 2D körülmények között történt. Ez a következő lényeges korlátokkal járt:

1.ábra. A céltérfogat, a gerincvelő és a sugármező vetülete a sugárforrás egyik nézőpontjából (+90)
Hagyományos 3D besugárzástervezés
A 2D tervezés ismertetett korlátai miatt az 1980-as évek elején három centrumban indult el a 3D besugárzástervező programrendszerek kidolgozása: Goitein, Kijewski és mtsaik (Harvard), Schlegel és mtsai (Heidelberg), Fraass, McShan és mtsaik (Ann Arbor). Ennek előfeltétele volt a nagy teljesítményű számítógépek megjelenése, az interaktív számítógépes grafikai rendszerek kidolgozása, valamint az újabb metszetképalkotó diagnosztikai eljárások (elsősorban a számítógépes rétegvizsgáló = computertomográf = CT) kifejlesztése és eredményeinek a tervezésbe történő közvetlen integrálása.
A fizikai értelemben vett 3D besugárzástervezés alapvetően azzal jelent többet a különböző síkokban készült 2D tervek soránál, hogy a szomszédos területek szöveti inhomogenitásviszonyait is képes tekintetbe venni.
A tervezés első lépéseként párhuzamos síkokban, a leendő sugárkezelési körülmények között, a besugárzástervező programrendszerrel kompatibilis számítógépes rétegvizsgálóval felvételsorozat készül. A testkontúron kívül elhelyezkedő CT-adatok eltávolítása után a térfogatelemek (voxelek) Hounsfield-(sugárelnyelési)-értékeinek felhasználásával 3D szöveti elektronsűrűségi mátrix alakítható ki. Ennek kettős célja van:
A tervezés következő fázisában a majdani sugárkezelés 3D szimulálását kell elvégezni. A gyors, interaktív szimulálás alapkoncepciója a “sugárforrás nézőpontja" (beam's eye view) elvének alkalmazása. A besugárzástervezés e talán legeredetibb módszerének lényege az, hogy a tervezés során az anatómiai információk és a kiválasztott irradiációs paraméterek úgy jelennek meg a képernyőn, mintha azokat a sugárforrásból kitekintve, mintegy sugártávlatból látnánk (1. ábra). Az adott cél elérése érdekében ez tűnik a legtermészetesebb nézőpontnak és eljárásnak.
A 3D besugárzástervezés óriási értéke a dózisszámítás eredményének képi- és numerikus megjelenítése. Ez az alapja a tervek összehasonlíthatóságának, illetve az optimalizálásnak. Az értékelés a dózismátrix normalizálásával kezdődik. Ezt konvencionálisan a legnagyobb dózisszintű voxelre végezzük el, s a továbbiakban a relatív dóziseloszlási viszonyokat tanulmányozzuk.
A képi értékelés a tervek elemzésének és összehasonlításának hagyományos lehetősége. 3D esetén mód van arra is, hogy a dózisviszonyokat rekonstruált testszeleteken - axiális, koronális, sagittális -, valamint perspektivikus képeken ábrázoljuk (2a-b ábra). Az információ megjeleníthető egyenként, szekvenciálisan szubtrakcióval, illetve statikus formában vagy filmszerűen. A képi összevetésben bizonyos szubjektív komponens mindig fellelhető, de ugyanakkor ez a tényező segít a tervezési folyamat további alakításában.
A numerikus értékelés során a nevezetes térfogatok relatív abszorbeált differenciális és integrál térfogati dózisviszonyait számítjuk ki. Az eredményeket olyan koordináta-rendszerben ábrázoljuk, melynek vízszintes tengelyén a relatív dózis, a függőleges tengelyén pedig a térfogatelemek száma (differenciális dóziseloszlás), illetve a térfogatszázalék (integrál dóziseloszlás) szerepel.
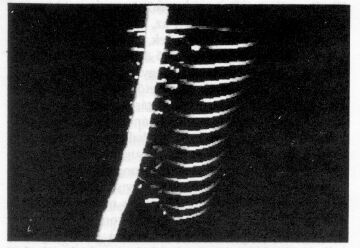
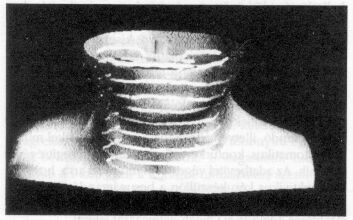
2.ábra. A céltérfogat, a gerincvelő és a testkontúr
3D perspektivikus képe a 80 %-os (a), valamint az 50 %-os izodózisszalagokkal (b)
multileaf-kollimátort alkalmazó izocentrikus mozgómezős besugárzás esetén Alderson-
RANDO-fantomban. 15 MV X-sugárzás; izocentrum: a céltérfogat geometriai középpontjában;
forgás: kétszer -120° +120° a gerincvelőt védve jobb, illetve bal oldalról; a céltérfogat
perifériáján lévő biztonsági zóna 3 mm-es. A programrendszer fejlesztésének időszakában
a humán szövetek sugárelnyelési viszonyait szimuláló emberformájú fantomról készített
CT-felvételeket használtunk. A fantomot először az Alderson Laboratóriumban állították
elő, s azóta alteregói világszerte sugárfizikai referenciaként szolgálnak a számított
és mért adatok összehasonlíthatósága érdekében. (A RANDO név mozaikszó: Radiation
ANalog DOimery kifejezésekből ered.)
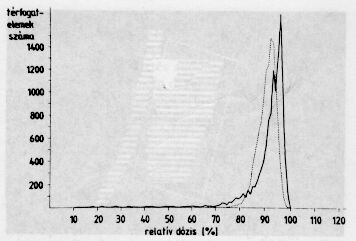
3.ábra. A céltérfogat relatív abszorbeált differenciális térfogati dóziseloszlása két rivális terv esetén. A pontokkal jelölt görbe olyan terv alapján készült, ahol a céltérfogat lényegében a kívánt 80 % feletti izodózistartományba került. A másik terv esetében 10 %-nál kezdődnek az izodózisértékek, ami klinikai szempontból nem fogadható el.
A 3.ábrán alternatív tervek dózisviszonyainak összevetését mutatjuk be, melynek segítségével ki lehet választani az előnyösebb besugárzási módszert. Az optimalizálás objektíwé tétele ellenére nem biztos, hogy a numerikusan legelőnyösebb tervet használjuk fel a sugárkezelés kivitelezésekor. Ennek az az oka, hogy az irradiáció elvégezhetősége egyéb tényezőktől is függ, például: tud-e a beteg az adott helyzetben feküdni, reprodukálható-e biztonsággal a besugárzás valamennyi paramétere stb.
A sugárkezelés kivitelezésének pontossága érdekében ma már elengedhetetlen követelmény a jóváhagyott terv adatainak számítógépes rögzítése, a besugárzási paraméterek ellenőrzése, vezérlése a beállítás és a sugárkezelés alatt. 'További ellenőrzési lehetőséget jelent az, hogy a tervezéshez használt CT-felvételek alapján digitális írton olyan képek készíthetők, melyeknek szükségképpen egyezniük kell a beállítást szimuláló röntgenfelvétellel. Az ilyen típusú digitális képek létrehozásakor is a “sugárforrás nézőpontja" elvet alkalmazzuk a visszavetítés (back-projection) során.
A pajzsmirigydaganatok előzőekben vázolt, bonyolult tervezési problémáját a hagyományos 3D besugárzástervezés eszközeivel sem lehetett maradéktalanul megoldani. Ennek két oka van:
Dinamikus besugárzástervezés
A bonyolult céltérfogatok alakját minden tekintetben követő és az ép szövetek lehető legteljesebb védelmét biztosító konformációs besugárzás dinamikus sugárterápiát igényel. Ennek lényege, hogy egyes, de akár az összes módosítható besugárzási paramétert folyamatosan vagy közel folyamatosan, a szükségletnek megfelelően változtatjuk. Ez idő szerint a besugárzóasztal és -fej helyzete, a sugármező alakja és a dózisteljesítmény módosítható.
A sugármező alakjának változtatására elsődleges és másodlagos kollimátor-rendszerek alkalmasak. Ez utóbbiak egyik típusa a multileaf-(=sokszeletű)-kollimátor, ami több, egymással szemben álló, függetlenül és tetszőlegesen mozgatható lemezből, szeletből áll.
Az első berendezést 1906-ban Robinsohn készítette, de az 1960-as évekig nem merült fel sugárterápiás alkalmazásának sem lehetősége, sem igénye. Ekkor Takahashi végzett úttörő munkát a konformációs sugárkezelési módszerek kidolgozásában, illetve a multileaf-kollimátor továbbfejlesztésében. Az általa megálmodott besugárzási terveket két ok miatt nem lehetett abban az időben megvalósítani: nem volt mód 3D tervezésre, illetve a technikai berendezések nehézkesen működtek.

4.ábra. Multileaf-kollimátor segítségével képzett, a céltérfogat alakját követő sugármező (fehér terület). A pontok a gerincvelő és az irradiációban nem részesülő céltérfogatrész vetületét jelölik. A sugárforrás nézőpontja: -30°.
A 3D besugárzástervező szoftverek elterjedése megteremtette a multileaf-kollimátorok alkalmazásának tervezési előfeltételét. Az elmúlt években a lineáris gyorsítókat gyártó cégek finomabb mechanikájú, számítógéppel vezérelhető kollimátor-rendszereket fejlesztettek ki. A betegkezelésekről szóló kezdeti beszámolók alapján összefoglaló közleményében Brahme azt jósolta, hogy e technikai segédberendezés jelenti a jövő legnagyobb ígéretét a bonyolult irradiációs tervek kivitelezése szempontjából.
A multileaf-kollimátor alkalmazása lehetőséget ad a pajzsmirigydaganat patkó alakú céltérfogatrészének besugárzására is. Ehhez azonban a hagyományos 3D tervezés “beam's eye view" elvének átértékelése szükséges, mivel az nem teszi lehetővé a konkáv kontúr érzékelését és követését. A speciális konkáv kontúrkereső algoritmus kialakításakor legelőször a következőt kellett belátnunk: egy konkáv alakzat besugárzását csak akkor lehet elvégezni mozgómezős besugárzással, ha a céltérfogat egésze nem részesül a sugárforrás minden egyes helyzetéből direkt besugárzásban. A céltérfogat árnyékolásának kijelölésére a gerincvelő kontúrja látszik kézenfekvőnek. Ezzel egyúttal a kritikus szerv védelmét is meg lehet oldani (Ésik és mtsai). Olyan két, folyamatosan és automatikusan változó multileaf-kollimátoros mozgómezőre van szükség tehát, melyek közül az egyikkel a gerincvelőtől jobbra, a másikkal pedig a gerincvelőtől balra elhelyezkedő céltérfogatrészt sugarazzuk be, s ugyanakkor a gerincvelőt, illetve a vetületében elhelyezkedő és az ellenoldali daganatrészt árnyékoljuk (4.ábra).
Az ily módon kialakult dózisviszonyokat 3D perspektivikus képekkel és izodózisszalagokkal a 2a-b.ábrán mutatjuk be. A céltérfogat teljes egészében a daganat alakját követő 80 %-os izodózisszalagon belül helyezkedik el. Jól érzékelhető, hogy az ép szövetek terhelése az adott körülmények között igen alacsony. Az 50 %-os izodózisgörbe a nyaki gerincvelőt éppen súrolja, ami klinikai szempontból elfogadható. A módszer alkalmazásának technikai előfeltétele a számítógéppel automatikusan vezérelhető multileaf-kollimátor-rendszer.
A sugármező alakjának másodlagos módosítására szolgáló további eszköz a beteg és a besugárzófej közé helyezhető sok-kollimátoros-gyűrű. A gyűrűben levő 8 ablakon át olyan tetszőleges választott sugármezőkkel történik a besugárzás, melyek megfelelnek a sugárforrásból látható 2D céltérfogat-vetületnek. A mező formájának kialakításakor a sugárforrás nézőpontja elvet alkalmazzuk, az öntés woodfémből történik. A különböző formájú sugármezők egymás utáni állómezős besugárzása lehetővé teszi a megfelelő dózisviszonyok kialakítását (Németh és Schlegel). A fémöntés a módszer alkalmazását nehezíti.
A Schlegel-munkacsoport által Heidelbergben (Deutsches Krebsforschungszentrum) mintegy 170 emberévnyi munkával kifejlesztett VOXEL-PLAN-HEIDELBERG elnevezésű 3D programcsomagot a cikk szerzői által végzett programfejlesztési munka ellenértékeként az Országos Onkológiai Intézet Sugárterápiás Osztálya megkapta. (Összehasonlításként megadjuk, hogy a Siemens által Axiom néven forgalmazott 3D besugárzástervező software ára 430000 márka.) Az üzemeltetéshez szükséges hardware és periféria értéke a programcsomag árának felét teszi ki. Ennek megvásárlását OMFB-pályázat útján elnyert 10 millió Ft tette lehetővé. A rendszer működésének megindulása néhány hónapon belül várható.
A 3D sugárkezelési eljárás hazai bevezetése a szakmai tevékenység korszerűsítése mellett azt jelenti, hogy a pontosabb tervezési és kivitelezési folyamat következtében a daganatos betegek közül több nyerheti vissza munkaképességét. Ezen túlmenően, a minőségileg jól kivitelezett terápia után kevesebb a kiújulás, aminek az ellátása többnyire költségesebb, mint maga az első kezelés.
Irodalom