Fizikai Szemle honlap |
Tartalomjegyzék |
Hermecz István
CHINOIN, Budapest
Az előadók igen színvonalas előadásaiból igen alapos, és egyben kritikus áttekintést kaptunk a gyógyszerkutatás egyik leghatékonyabb eszközéről, a fehérje-krisztallográfiáról és ennek során a szinkrotron-sugárzás alkalmazásáról. Ugyan ma nem volt szó a célfehérje azonosításáról, fáradtságos izolálásáról, továbbá a sok türelmet és még több szerencsét igénylő fehérjekristályosítási kísérletekről, viszont megvitattuk az adatgyűjtés, a szerkezetmegoldás lehetőségeit, valamint az eredmények alkalmazását enzimmechanizmusok felderítésére és a fehérje-kismolekula komplexek térszerkezet-adatainak felhasználását gyógyszer tervezésében.
Örömmel állapíthatjuk meg, hogy együttműködések keretében Magyarországon is megteremtődött a lehetőség arra, hogy e "high-tech" kutatási módszert alkalmazzuk a gyógyszerkutatásban. Erre részben Náray-Szabó akadémikus által 1994-ben az Eötvös Loránd Tudományegyetemen fehérjék vizsgálatára is alkalmas röntgendiffrakciós készülék felállításával és beindításával, részben az itt nem vizsgálható kristályok szinkrotron-sugárzással történő vizsgálatával van lehetőség. Utóbbira a Szinkrotron Bizottság tagjainak, illetve e területen külföldön dolgozó kollégáik segítségével van lehetőségünk.
Mint láthattuk, a fehérje-krisztallográfia teljesítményét nagymértékben fokozza a szinkrotron-sugárzás alkalmazása, amelynek felhasználása ennél sokkalta szélesebb körű. Napjainkban a szinkrotron-sugárzást, mint a röntgensugárzás korszerű változatát tartjuk számon. Így alkalmazása a fehérje-krisztallográfiában lényegesen rövidebb expozíciós idő mellett is gazdagabb információt szolgáltat kevésbé stabil, esetenként még olyan gyengébb minőségű kristályokról is, amelyek a hagyományos módszerekkel már nem vizsgálhatók.
Arra a kérdésre, hogy mit várhatunk e technikák együttes alkalmazásától, a választ egy példán keresztül adom meg.
Lassan 100 évre visszanyúló probléma
a nem-szteroid gyulladásgátlók (például
aszpirin, indometacin) ismert mellékhatásának,
a tartós adagolás mellett fellépő
ulkuszképző tulajdonság megszüntetése.
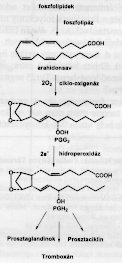
Ismert, hogy a nemszteroid gyulladásgátlók
az arahidonsav kaszkád (1. ábra) ciklo-oxigenáz
(COX, vagy újabban prosztaglandin H2
szintetáz, PGHS) enzimjét gátolva fejtik
ki hatásukat. Az újabb vizsgálatok kimutatták,
hogy ennek az enzimnek két izoenzim formája található
meg a szervezetben: COX-1 és COX-2, vagy PGHS-2 és
PGHS-2, melyek szabályozó szerepe különböző.
Amíg a COX-1 izoenzim, amely folyamatosan jelen van a sejtekben
és a normál sejtműködés és
életfolyamatok szabályozásában játszik
szerepet, addig a COX-2 izoenzim megjelenését specifikus
stimuláló események indukálják,
amelyek például gyulladás kialakulása
vagy nitrogenezis válasz során lépnek fel.
Úgy vélik, hogy napjainkban alkalmazott nemszteroid
gyulladásgátlók azért okoznak ulkuszt,
mert nem elég szelektívek, azaz nemcsak a COX-2,
hanem a COX-1 izoenzimet is gátolják. E felismerések
nyomán gyógyszerkutatók figyelme szelektív,
csak COX-2 izoenzimet gátló vegyületek kutatására
összpontosul.

Sikeres megoldáshoz jelenthet segítséget, ha a két izoenzim felépítését és működését, azonosságukat és különbözőségüket megértjük. Krisztallográfiai vizsgálatuknál nehézséget jelent, hogy membrán-kötött fehérjékről van szó, melyek izolálása és kristályosítása az átlagosnál bonyolultabb feladatot jelent. Napjainkban születtek meg azok az első fehérje-krisztallográfiai eredmények, melyek jelentős áttöréssel kecsegtetnek.
Garavito és munkatársai erőfeszítései
1994-ben vezettek eredményre a chicagói egyetemen.
Sikerrel kristályosították juh COX-1 izoenzim
fluorbiprofinnal alkotott komplexét, amelyekről
szinkrotron-sugárzás alkalmazásával
nyertek olyan felvételt, amely a kristályszerkezet
megoldásához vezetett [1, 2]. A következő
évben sikerrel oldották meg a COX-1 és aspirin
bróm származék komplex szerkezetét
is [3]. E vizsgálatok során egyértelműen
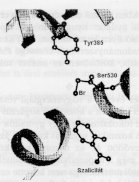
igazolták azon feltevésnek helyességét,
hogy az aspirin hatását az izoenzim 530-as szerin
aminósav-egységének acilezésén
keresztül fejti ki (2. ábra). Emellett
a szalicilsav blokkolja annak a hosszú hidrofób
csatornának a bejáratát, amely az enzimműködéshez
kulcsfontosságú 385-ös tyrozin aminósav
egységhez vezet. A többi nem szteroid gyulladásgátló
is hasonlóan kötődik az enzimhez.
1996-ban számoltak be a humán COX-2 izoenzim - amely 67 %-os aminósav-szekvencia hasonlóságot mutat a juh COX-1 izoenzimmel - kristályszerkezetének megoldásáról [4].
Ezek az ismeretek, kombinálva egyéb modern gyógyszertervezési stratégiákkal és módszerekkel, várhatóan rövid időn belül elvezethetnek egy szelektív, csak a COX-2 izoenzim-működést gátló felfedezéséhez, és a terápiába történő bevezetéséhez, a közel 100 éve várt eredményhez.