
Fizikai Szemle honlap |
Tartalomjegyzék |
Fizikai Szemle 2000/11. 374.o.
Köteles György
Országos “Frédéric Joliot-Curie" Sugárbiológiai
és Sugáregészségügyi Kutató Intézet, Budapest
Az egészségkárosítás kockázatbecslésének alapja a biológiai hatások ismerete és a dózis/expozíció/koncentráció, illetve a dózis-hatás összefüggések megállapítása. Az ionizáló sugárzás esetében a lineáris-küszöbnélküli modell érvényessége a sztochasztikus hatások valószínűségére a nemzetközi vita középpontjában áll. Az utóbbi évtizedben kibontakozott vita az ionizáló sugárzások kis dózisainak kockázatáról egyik következtetése, hogy tovább kell folytatni az epidemiológiai vizsgálatokat és a sejtszintű sugárbiológiai kutatásokat. Utóbbit nemcsak az indokolja, hogy a rosszindulatú sejtátalakulások valószínűségét és mechanizmusát kellene mélyebben vizsgálni, hanem elemezni kell az egyéb sugárzás kiváltotta sejtválaszokat, ezeken belül különösen azokat, amelyek módosítják a sugárzás hatását akár a súlyosbítás (érzékenyítés), akár a gyengítés (védelem) irányában. Ezen sejtválaszok között manapság a figyelem előterében állnak a gén instabilitás, a közelhatás (“by-stander-effect"), illetve az alkalmazkodás módozatai. A sugárvédelmi filozófia korszerű alakítása érdekében a vizsgálódást a sejtszintű jelenségektől tovább kell terjeszteni a szöveti, szervi, illetve a teljes szervezet válaszreakcióira. A kis dózisok hatását ezek a biológiai reagálások módosítják. Így a kis dózisokkal kapcsolatos szemléletünket befolyásolják, még ha egyelőre nem is indokolják a sugárvédelmi szabályozás megváltoztatását.
A kockázatbecslés egyes elemei
A kockázatbecsléshez ismernünk kell egy hatás jellegét, kórtani következményét, azt a dózistartományt, amely a hatást kiváltja, kellő pontossággal le kell tudnunk írni a dózis-hatás összefüggést.
A sugárvédelem eddig érthetően a rák-keletkezés kockázatával foglalkozott. A valóságban előfordult expozíció, hatóanyag-koncentráció, illetve dózistartomány kockázatára vonatkozóan a sztochasztikus hatásokra elfogadott lineáris küszöb-nélküli dózishatás összefüggés (LNT = Linear No Threshold) bizonyult megfelelőnek. Ezt fogadták el széleskörűen számos epidemiológiai elemzésben, például a földalatti uránbányászok hörgőrák-gyakoriságában, az atombombázást túlélők rák-halálozásában. Az epidemiológiai statisztikai elemzések és következtetések elbizonytalanodása 100-200 mGy alatt, radon expozíció esetében 400 Bq/m3 alatt azonban kérdésessé teszi az LNT érvényét ezen értékek alatt, azaz a sugárvédelem számára releváns dózisoknál.
A tudományos közvéleményben konszenzus alakult ki, hogy a dilemma megoldása két fő irányból közelíthető, nevezetesen az epidemiológiai vizsgálatok kiterjesztésével, valamint a sejtszintű sugárbiológiai kutatások útján. (A sejtszintű sugárbiológiai kutatások eredményeinek értékelésénél, például különböző kromoszóma-aberrációk megjelenésénél a hozam sokszor kifejezhető a három fő összefüggés típus mindegyikével, a lineáris, lineáris-kvandratikus vagy kurvilineáris függvényekkel. Ez utóbbi a kis dózisok tartományában a dózis-hatás összefüggéseket nem teszi egyértelművé.)
Sugárhatást módosító tényezők
Fizikai jellegűek: Sugárhatást módosító tényezőkkel mát korábban is számoltunk. Így a sugárzás LET (lineáris energia-transfer) értéke, a sugárzás dózisteljesítménye, a besugárzás jellege (akut, krónikus vagy frakcionált). Maga az ICRP is bevezette a dózis-dózis teljesítmény-hatékonysági tényező érékét (DDREF) a sztochasztikus hatások kockázatának becslésében.
A kémiai jellegűekhez az endogén és exogén antioxidáns és sugárvédő, valamint sugárérzékenyítő vegyületeket soroljuk. E téren az irodalomban az antioxidáns vegyületek és kapacitás feltérképezése folyik. Magunk is foglalkozunk az egyéni antioxidáns kapacitás mérésével.
A biológiai jellegűek között ismert volt néhány sejtélettani jellegzetesség: oszló és nem oszló sejt különbsége, vagy a sejtoszlási cikluson belül elfoglalt helye, a sejtcikluson belül a fázisok szerepe. Újabban e téren sok ismeret halmozódott fel, mint a génaktiválás és géngátlás jelenségei, a sejtciklusszabályozás szerepe, a sejt-sejt kommunikáció módozatai.
A hatásokat kiváltó dózisok a legtöbb vizsgált rendszerben gray nagyságrendűek. Kérdés, hogy kisebb dózisok kiváltják-e ezeket a hatásokat, és ha igen, milyen dózistartományig. Ami a dózisküszöböt illeti, ha ilyen észlelhető, ez valószínűleg annyit jelent, hogy a jelenség kimutatási határát értük el (az adott módszer érzékenységétől függően). Dózis-hatás összefüggésekre még szinte alig van adat. Érdekes megjegyezni, hogy például a genetikai instabilitás vizsgálatánál 2-12 gray között nem találtak dózisösszefüggést. Ebből arra következtetnek, hogy a jelenséget ennél kisebb dózisok okozzák.

A sugárhatást módosító biológiai tényezők között az újabban megismertek állnak az érdeklődés előterében (1. ábra). Ezek közül a kockázatot növelik:
Géninstabilitás
Számos sejtszintű sugárbiológiai vizsgálat azt engedte sejteni, hogy ionizáló sugárzás emlős sejtek tenyészetében a teljes génállományra kiterjedő instabilitást eredményez, ami átadódik a sejtek számos generációján át, azaz az eredetileg besugárzott sejt nem besugárzott utódaiban nő a genetikai változások gyakorisága, a mutációk és kromatid aberrációk száma, csökken az oszlásképesség, az élettartam, nő a malignus átalakulások gyakorisága. A folyamat oka és következménye a kromoszóma destabilizáció és gén amplifikáció. Lehet, hogy ez a jelenség a carcinogenezis első lépése. A kiváltó dózisok 4-12 Gy tartományban voltak. Kezdetben a jelenséget nagy LET értékű
![]() -sugárzás alkalmazásával észlelték, de később kis LET értékű röntgensugárzással is.
-sugárzás alkalmazásával észlelték, de később kis LET értékű röntgensugárzással is.
A jelenség értékelésének nagy súlyt ad az a tény, hogy a hatás az involvált sejtkultúrák 10-20%-át érintette. Figyelembe véve, hogy a fenti dózistartományban a génmutáció valószínűsége 10-5, úgy tűnik, hogy a hatás kiváltásának céltárgya nem egy-egy gén, hanem a teljes génkészlet. Ez viszont felveti az a gondolatot, hogy a hiper-mutabilitás állapotában későbbi genotoxikus hatások fokozott jelentőséget kapnak az instabilitás “genom-wide" jellege miatt. Nem zárhatók ki epigenetikai (génstruktúrán kívüli) hatások, mint az apoptózis (sérült sejtek beprogramozott sejthalála) gátlás TRP53 génmutáción vagy membránváltozásokon, membráneredetű genotoxikus anyagok (ceramidok) felszabadulásán keresztül.
Sajátos helyzetnek tűnik, hogy a mutációkon belüli DNS-struktúraváltozások különböznek a közvetlen sugárzás okozta DNS változásoktól: részleges molekula hiányok, deléciók fordultak elő, a mutáns sejtekből gyakran hiányzott génszegmentek (exonok) összefüggése.
A géninstabilitás állapotát a sejtekben biokémiailag jellemzi az intracelluláris oxidánsok növekedése, szuperoxid aniongyök-képződés fokozódása, a DNS-bázisok oxidatív károsodásai, membránok fokozott sebezhetősége szabadgyökökkel.
Bizonyos sejtbiológiai változások olyan sejtekben is kialakulnak, amelyek közvetlenül nem kaptak ionizáló sugárzást. Így például testvér kromatida kicserélődést, egyes gének (TRP53, sejtciklus gének) aktiválását, HPRT mutációk gyakoriságának növekedését figyelték meg CHO sejtekben 238Pu-alfa sugárzás következtében. Utóbbi esetben lineáris dózis-hatás összefüggést is leírtak 5 cGy és 1,2 Gy között. Sőt 5 cGy alatt aránytalanul nagyobb mutációs gyakoriságot figyeltek meg, mint ami az extrapolálásból következtethető lett volna, amikor is az átlagos alfa-nyom sejtenként 0,05 és 0,3 között volt. A jelenséget azóta többféle sejten és sugárzás típusra is leírták.
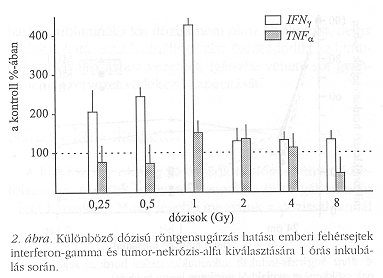
A jelenség mechanizmusa feltehetően a sejt-sejt kommunikáció útján, a sejtmédium közvetítésével, vagy szabad oxigéngyökök diffúziója révén következhet be. A sejt-sejt kommunikációban citokin közvetítés is előfordulhat. Magunk már korábban is észleltük (2. ábra), hogy a citokinek mennyisége viszonylag kis dózisok következtében tenyésztett sejtekben jelentősen növekszik.
Alkalmazkodási válasz
Kis dózis hatására a sejt néhány órán belüli nagyobb dózisokra sokkal kevesebb sérüléssel reagál, mintha csak a nagy dózist kapta volna. Ezt az alkalmazkodási választ többféle emberi (normál és daganatos) sejtben kimutatták, továbbá G1 limfocitákon és fibroblasztokon is. Magunk G0 fázisú limfocitákon is észleltük (3. ábra).
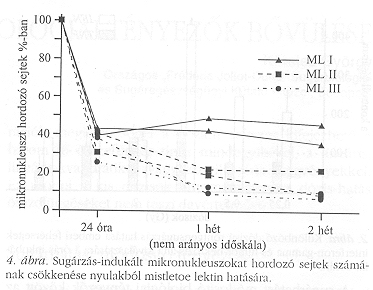
Egyes tenyésztett sejteken (például a C3H10T1/2 kultúrákon) néhány mGy után a spontán rosszindulatú átalakulás gyakorisága is csökkent. Jellemző, hogy az alkalmazkodási válasz kiváltásának a kis dózistartományban bizonyos “ablaka" van, nevezetesen mintegy 5 és 200 mGy között váltható ki a jelenség. Oka meglehetősen komplex lehet, szerepet játszhat az oxigén-gyökök hatékonyabb detoxifikálása, indukált javító-enzim szintézis fokozódása, vagy szövetekben a sérült sejtek fokozott eltávolítása. Utóbbi feltehetően apoptotikus folyamat (a károsult sejt öngyilkossága) révén megy végbe. Magunk is kimutattuk, hogy egy apoptózist indukáló exogén tényező, a mistletoe lectin a mikronukleusz megjelenésében manifesztálódó sérüléseket hordozó sejteket eltünteti a szervezetből (4. ábra).
Érdekes megjegyezni, hogy az ilyen adaptív válaszadási reakció okozhat “küszöbdózist", amely alatt egy sejtbiológiai jelenség - akár a rosszindulatú átalakulás - nem jelenik meg szövetkultúrában, vagy élő szövetekben.
Génreguláció
A sugárzás indukálta változásokkal a génregulációban hatalmas mennyiségű szakcikk foglalkozik. Itt csak arra szeretnék rámutatni, hogy sokféle gén indukálódik különböző kinetikákkal, sőt a sugárzás-fajtáktól is függően: például gamma- és neutron-sugárzás különböző reakciókat válthatnak ki. Az egyes gének aktiválása perceken belül, akár 10 mGy után is bekövetkezhet. (Erre vonatkozó adatok vannak a TNF-alfa proteinkináz C-n keresztüli aktiválására, a TRp53 gén alfa sugárzást követő aktiválására, a kappa B nukleáris faktor aktiválására oxigén gyökös jelzésen át.) Az indító jel eredhet DNS-sérüléstől, vagy epigenetikai úton a citoplazma vagy sejtmembrán sérülése után. Utóbbi esetben megfigyelték, hogy a membrán-lipidekből a ceramid képződése apoptózis gátláshoz és ezen keresztül gén instabilitáshoz vezethet, miként a TRp53 gén elvesztése is.
A sokat vitatott hormézis, azaz kis dózisok jótékony stimuláló hatása, melynek szintén igen nagy az irodalma, az alkalmazkodási kategóriába tartozik.
Egyéni fogékonyság és érzékenység
A lakossági egyéni dóziskorlátok megállapításánál mind nagyobb jelentőséget kap az egyéni érzékenységek megismerése, jellemzése. Emberi populációban a különböző mutációk száma 10-es tényezővel változhat. A sugárbiológiában a DNS-helyreállító mechanizmusok csökkentértékűsége vagy hiánya jól ismert egyes betegségekben is manifesztálódó állapotokban (Bloom-szindróma, Fanconianémia, Werner-szindróma, ataxia-teleangiektázia stb.). Az utóbbi időben különös figyelmet érdemelnek kis dózisokat követő mutációs gyakoriság előfordulások, például a csernobili helyreállító személyzet (“likvidátorok") esetében már 100 mGy után a HPRT mutációs gyakoriság emelkedését figyelték meg. Kérdés, hogy valóban léteznek-e olyan érzékeny egyének, akik a “mutátor fenotípus"-hoz tartoznak.
Nyilvánvaló, hogy az egyéni fogékonyság és érzékenység mértékét az endogén védekező mechanizmusok befolyásolják, például az antioxidáns rendszer, s az is, hogy ezt exogén antioxidánsokkal támogatni lehet. Magunk nagyszámú személy felmérésével megállapítottuk, hogy a vérszérum összes antioxidáns kapacitása az egyének között mintegy 2-es faktorral változhat. Azt is kimutattuk, hogy az alkalmazott mérési módszerrel a kívülről támogatott antioxidáns szintet mérni, ellenőrizni lehet. Gyakorlati sugárvédelmi jelentősége van annak a megfigyelésünknek is, hogy ionizáló sugárzás emelkedett antioxidáns kapacitású vérben kisebb klasztogén hatású, egy adott dózis kevesebb interfázisú kromoszóma aberrációt, azaz mikronukleusz előfordulást eredményez, mint a kis antioxidáns kapacitású személyekben.
A reagálások szintjei
Az ionizáló sugár-hatás módosításának szintjei különbözőek lehetnek. Nyilvánvaló, hogy az első szint maga a sejt, ezen belül is a kromatin-állomány. A DNS különféle sérüléseit (pontmutációktól kezdve többszörösen sérült helyekig) a helyreállító mechanizmusok, illetve gyökfogók, antioxidánsok jelenléte csökkentheti. A sejtpatológiai indukált folyamatok a DNS-molekulán kívül bevonnak egyéb sejtmagi, vagy citoplazmai struktúrákat, ezek is lehetnek károsító, gyengítő, vagy potenciálisan károsító jellegűek, vagy éppen a sugárhatást enyhítő, vagy kiküszöbölő jellegűek. Az epigenetikai változások visszakapcsolhatnak a sejtmagi központokra. A szövetek, szervek sugárérzékenységét, az ott lezajló sugárhatást módosító folyamatokat az aktuális sejtösszetétel határozza meg. Végül eljutunk az egyéni érzékenység, fogékonyság komplex dilemmájához. Nyilvánvaló, hogy az egyéni válaszok kialakulásában igen sok tényezőnek van szerepe akár az érzékenység, akár az ellenálló képesség fokozása irányában. Talán annak realizálása igényli a legfontosabb korszerű szemléletet, hogy az embert egyszerre többféle környezeti hatás érheti, amelyek közül az ionizáló sugárzás csak az egyik tényező. Így tehát az egyéni reagálásnál (komplex kockázatbecslésnél, a szervezet állapotát vizsgáló diagnosztikai módszerek alkalmazásánál, kutatásánál, az ellenálló képesség fokozásánál, vagy egy esetlegesen már kialakult patológiás állapotnál, betegségnél) ezeket figyelembe kell venni. A közegészségügy, a munka- és foglalkozás-egészségügy így függ össze a sugáregészségüggyel. A kombinált hatások kutatása éppen a kis dózisoknál fontos, lett légyen akár sugárzás, akár egyéb (például kémiai) hatás, ugyanis feltételezhető, hogy egy-egy hatás szubliminális kis dózisa nem okoz elváltozást, de ha többféle hatás szubliminális dózisa összeadódik, az kimutatható elváltozáshoz vezethet, igénybe veheti, sőt gyengítheti a szervezet védekező kapacitását.
Néhány következtetés
A kis dózisok okozta hatást sok biológiai tényező befolyásolja. A sejtek, szövetek reagálása önmagában nem jelent károsítást. Minél lejjebb megyünk a dózissal, annál inkább szerephez jutnak az endogén és exogén módosító-védő tényezők. A “károsítás" feltehetően csak a védelem “áttörése" után következik be.
Attól, hogy valamilyen hatás még nem mutatható ki, attól az még létrejöhet. A kimutathatóság a módszerekkel változik, de az észlelt elváltozást kiváltó dózis lehet “tűrhető", vagy “marginális", főleg ha egyéb civilizációs kockázatokkal hasonlítjuk össze. A kimutatás érzékenysége még nem jutott el a jelenlegi dóziskorlátok szintjéhez, ezért utóbbiak ez idő szerint megfelelőnek tarthatók.