Érdemes megemlíteni, hogy Gay-Lussac már öt évvel korábban, 1802-ben publikálta a gázok
hőtágulására végzett kísérleteinek eredményét. [4] Kísérleteit levegővel,
oxigénnel, nitrogénnel és hidrogénnel végezte Laplace felkérésére, aki erősen hitt a gázok egyforma
viselkedésében. Gay-Lussac 1799-től volt az Ecole Normale Politechnique hallgatója, s Laplace
1794 óta tanított ott. Az első, 1802-es publikációt követően Gay-Lussacot nevezetes, léggömbön
végzett kísérletei (1804, Biot-val közösen), majd olaszországi és németországi tudományos útjai
(1805, Alexander Humboldttal közösen) kötötték le. 1806-ban tért újra vissza Berlinből Párizsba,
ahol 1809-től lett az Ecole Normale Politechnique kémiatanára. Az 1807-es publikációt megelőző
években Dalton és Davy Angliában, Volta pedig Itáliában végzett hasonló méréseket.
A hőanyagelmélet teljes virágzását élte, forradalmian új gondolatok kémiában születtek ekkor. A
flogiszton-elméletet Lavoisier kvantitatív kémiai kísérletei döntötték meg, az anyag atomos
felépítésének hipotézise ekkor kezdett erőre kapni. Először a gázok kémiai reakcióinak magyarázatára
született meg Dalton atom és molekulahipotézise. Ebbe a kutatásba kapcsolódott be Gay-Lussac is,
ezért volt mindkettőjük számára fontos, hogy a gázok azonos tulajdonságait keressék.
A gázok egyforma hőtágulása mellett Gay-Lussac felállította a gázok egyforma fajhőjének hipotézisét
is. Pontosabban azt állította, hogy a gázok fajhője nem függ a gázok sűrűségétől (térfogatától). Ennek
igazolására végezte el azt a kísérletet, melyet a következőkben ismertetünk. Ez a kísérlet egyrészt a
második főtételt alátámasztó egyik közvetett bizonyítéknak tekinthető, másrészt az első főtétel
felfedezéséhez vezető egyik fontos lépés is volt a fizika történetében.
2. Gay-Lussac kísérlete - mai értelmezéssel
Vegyünk két azonos V térfogatú edényt, melyek a csappal vannak összekötve
(1. ábra).
Az egész rendszer legyen kívülről adiabatikusan szigetelve, ezt jelképezi az ábrán ferdén vonalkázott
keret. Kezdetben legyen ideális gáz csupán a baloldalon (a jobboldalon tehát vákuum van), így a
kezdőállapot jellemzői:
p1; V1 = V; T1;
U1
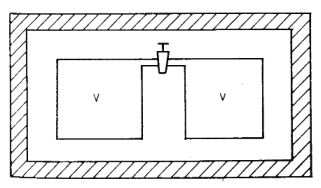
Nyissuk ki a csapot! Irreverzibilis, nem egyensúlyi állapotokon keresztül történő folyamat során a gáz kiterjed.
A folyamat végére az ideális gáz újra egyensúlyi állapotba kerül, e végállapot jellemzői:
p2; V2 = 2V; T2; U2,
Állítás: U1 = U2
Bizonyítás: Az első főtétel értelmében
U2 - U1 = Q + W
Most Q = 0 az adiabatikus szigetelés miatt, W = 0 mert a termodinamikai munka külso munka, s a környezet
nem végzett a gázon munkát.
Akármilyen gázzal is végezzük el a Gay-Lussac kísérletet, a gáz új egyensúlyi állapota tehát mindig ugyanolyan belső energiájú,
mint a kiindulási állapot volt. A hőmérsékletet mérni kell.
Gay-Lussac úgy végezte el a mérést, hogy az edényeket folyadékfürdőbe állította, s azt mondta, hogy ha
T2 ≠ T1, akkor ez megváltoztatja a folyadékfürdő hőmérsékletét.
(Elvileg igen, a hőkapacitások közti óriási különbség miatt azonban a gáz hőmérsékletváltozása gyakorlatilag mérhetetlenül
kis változást okoz a folyadékfürdő hőmérsékletében). Gay-Lussac nem kapott hőmérsékletváltozást, ezért arra következtetett:
T2 = T1
Ma már tudjuk, hogy az állítás helyes, de mint a fenti kísérletből levont mérési következtetés nem fogadható el. Gay-Lussac
kísérletének mégis fizikatörténeti jelentősége van. Az a felismerés, hogy az ideális gáz szabad tágulásakor hőmérséklete nem
változik meg, mind az energiafogalom kialakulásában, mind az ideális gáz kinetikus modelljének felállításában fontos szerephez
jutott.
Idézzük csak fel Robert Mayer nevezetes gondolatkísérletét! A hő és a munka közti kapcsolat felismeréséhez vezető egyik fontos
gondolata az volt hogy amennyivel több hő kell az ideális gáz 1°-kal való felmelegítéséhez állandó nyomáson mint állandó
térfogaton, annyi munkát végez a gáz az izobár tágulás közben. Dehát ebben a kétféle folyamatban azonos kezdőállapot esetén
a gáz két különböző végállapotba jut! A következtetés pedig csak akkor jogos, ha ugyanabból a kezdőpontból ugyanabba a
végállapotba jut mindkét esetben a gáz. Ehhez a kiegészítéshez volt szüksége Robert Mayernek Gay-Lussac kísérletére
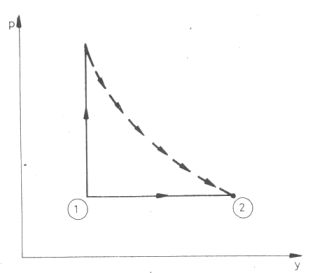
(2. ábra).
Az 1 állapotból kétféle módon visszük át a gázt a 2 állapotba:
- ; munkavégzés nélkül, csak hőközléssel. Ez két lépésben hajtjuk végre: először állandó térfogaton felmelegítjük
ΔT-vel, majd engedjük szabadon tágulni (miközben hőmérséklete a Gay-Lussac kísérlet tanulsága alapján
állandó marad);
- ; munkavégzés közben, izobár módon, a szükséges hő befektetése mellett.
A hőközlések közti különbség:
Qp - QV, = CpΔT - CVΔT
A végzett munka:
W = pΔV = RΔT mert a folyamat izobár.
Így jutunk az azóta már Robert Mayerről elnevezett összefüggéshez:
Cp - CV = R.
