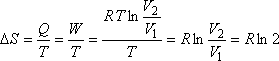
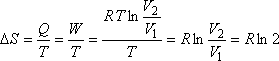
(ha V2 = 2
V
1) Csakhogy hőtartályba ágyazva ugyanennyivel csökken a hőtartály entrópiája, s így a{hőtartály + gáz}
összetett rendszer entrópiája nem változik, ahogyan azt egyensúlyi folyamatok során el is várjuk. Ebben az egyensúlyi folyamatban a gáz és a hőtartály entrópiaváltozása "kompenzálja egymást" (Clausius megfogalmazása), míg az irreverzibilis szabad tágulás során a gáz entrópianövekedését nem kompenzálja semmi a környezetben. A gáz entrópiája mindkét esetben ugyanannyit változik, mivel a gáz ugyanabból a kezdőállapotból ugyanabba a végállapotba jut, s az entrópia - állapotjelző. Fizikatörténeti háttér A Gay-Lussac-kísérlettel nem az a baj, hogy irreverzibilis, hanem az, hogy a mérési pontosság nem volt megfelelő. Ezen igyekezett javítani Joule. Robert Mayer 1845-ben adta ki német nyelven azt a munkáját, amelyben fent ismertetett gondolatmenetét publikálta s amelyben Gay-Lussac 1807-es kísérletére támaszkodott. Joule 1843-ban végezte el Gay-Lussac kísérletének módosított változatát a következő módon. A két azonos térfogatú edényt fémből készítette el, és külön-külön kaloriméterekbe helyezte el őket. A kaloriméterek térfogata csak kevéssel volt nagyobb, mint a fémedényeké, így viszonylag kis kapacitású volt a folyadék, ami a fémedényeket a kaloriméterekben körülvette. Ő is a folyadékok hőmérsékletváltozását mérte, s ebből következtetett a gáz hőmérsékletváltozására. A kiindulási állapotban az egyik edényt vákuumra szivattyúzta le, a másik edénybe pedig annyi levegőt pumpált, hogy nyomása 22 atmoszféra lett. Ezután kinyitotta a csapot, s a következő hőmérsékletváltozásokat tapasztalta: azon az oldalon, ahol eredetileg a 22 atmoszférás levegő volt, a hőmérséklet 2,36 F°-kal lett kisebb, a másik oldalon a hőmérséklet 2,38 F°-kal lett magasabb. [5] Mivel a két kaloriméter hőkapacitása egyenlő volt, ez azt jelenti, hogy ha a mechanikai egyensúly után sokkal lassabban beáll majd a termikus egyensúly is a két edényben levő gáz között, akkor a véghőmérséklet a mérési pontosságon belül meg kell hogy egyezzék a kiindulási hőmérséklettel. Joule körültekintő kísérletező ügyessége tette lehetővé, hogy a Gay-Lussac kísérlet visszanyerte eredeti bizonyító erejét. Már csak egyedül Joule nem volt megelégedve a mérési pontossággal. Az az igazság, hogy Joule, amikor eredeti formájában - tehát egyetlen közös kaloriméterben - ismételte meg Gay-Lussac kísérletét, mégiscsak kapott valamennyi hőmérsékletváltozást, de ez a mérési hiba határát súrolta. Azóta, hogy 1807-ben Gay-Lussac megfogalmazta nevezetes tételeit a gázok egyenlő viselkedéséről a kísérleti módszerek finomodásával egyre több kételkedő kutató lépett fel Gay-Lussac kijelentését cáfoló mérési adatokkal. A Francia Akadémia már 1811-ben pályázatot hirdetett a minél pontosabb kísérleti vizsgálatokra. Joule-ban két nézet viaskodott egymással. Egyik a gázok egyforma viselkedését értelmezni tudó molekuláris elmélet kidolgozásának reménye, amely szerint CV állandó. Másik a saját és mások kísérletei alapján felmerülő kétely CV állandóságában. Hogyan növelhető a fajhőmérések pontossága? Joule 1848-ban, Manchesterben egy tudományos felolvasóülésen kifejti azt a véleményét, hogy "azok a kutatások, melyeket Victor Regneault a francia kormány megbízásából vállalt a testek hőkapacitásának fontos problémáját is felölelik, így rövid időn belül új meghatározást várhatunk a gázok fajhőjére. Ezt a meghatározást ugyanaz a pontosság fogja jellemezni, amely teljesen megérdemelten szerzett dicsőséget ennek a híres kutatónak." [6] Ennél a híres kutatónál dolgozott néhány hónapig 1845-ben, miután Cambridge-ben matematikából és fizikából diplomázott - William Thomson. A Regnault által követelt nagy mérési pontosság indította Thomsont azokra a vizsgálatokra, amelyek az abszolút hőmérsékleti skála felállításához vezettek. Megszületett a tökéletes gáz absztrakciója, melyet a valódi gázok csak több-kevesebb pontossággal közelítenek. Itt Párizsban ásta ki a jótékony(?) feledés süllyesztőjéből a 21 éves Thomson az akkor már 13 éve halott Carnot-nak 1824-ben (Thomson születésének évében) publikált dolgozatát, és hazatérve Glasgowba 1848-ban közölte a termodinamikai hatásfokra alapozott abszolút hőmérsékleti skálát. Glasgow és Manchester mintegy 300 km-re vannak egymástól. Thomson és Joule szelleme számára ennél nagyobb távolság sem lett volna akadály barátságuk kialakulásához. Joule hat évvel volt idősebb Thomsonnál, először 1847-ben találkoztak [7]; lehet, hogy éppen Thomson hívta fel Joule figyelmét Regnault pontos méréseire. Ettől kezdve állandó levelezésben álltak egymással. Ha Thomson egyetemi előadásán valami új, frappáns demonstrációs kísérletet talált ki, azonnal megírta Joule-nak. Ugyanakkor Thomsont, akit lenyűgözött Fourier munkássága, amely még a hőanyag modelljével írta le matematikailag a hővezetés elméletét, egyedül Joule kísérleti eredményei győzték meg a hőanyagelmélet tarthatatlanságáról. [7, 8] Közös munkájuk legszebb eredménye annak az effektusnak a felfedezése, mellyel ipari méretekben megindulhatott a gázok cseppfolyósítása, s amely ma valamennyi háztartási hűtőgép működésének egyik nélkülözhetetlen feltétele, az un. Joule-Thomson effektus.