Fizikai Szemle honlap |
Tartalomjegyzék |
Fizikai Szemle 1995/5. 160.o.
Trón Lajos
Debreceni Orvostudományi
Egyetem, PET Centrum
Képalkotó eljárások
Az élő rendszereket jellemző életfolyamatok struktúrához kötöttek. A struktúra meghatározott komponenseihez igen gyakran részfunkciókat lehet rendelni, de ezek a funkcionális összetevők sem léteznek csak igen jól definiált szerkezeti felépítés mellett. Alapvető szerkezeti változások nem ritkán azzal a következménnyel járnak együtt, hogy a rendszer nem képes a funkcióját ellátni. A megváltozott funkció ugyanakkor szerkezeti változásokat is előidézhet. A funkció és a struktúra közötti igen szoros kapcsolat magyarázza, hogy az élő rendszerek tanulmányozása esetén (például humán diagnosztikai vizsgálatok körében) igen nagy jelentősége van a szerkezetvizsgáló módszereknek.
A szerkezetet analizáló eljárások között kiterjedten alkalmaznak egy sor olyan módszert, amely a vizsgált objektumról egy úgynevezett “képet" állít elő. A legáltalánosabb értelemben a kép fogalma úgy definiálható, mint a rendszer valamilyen (fizikai, kémiai, vagy egyéb) sajátságának a helyfüggése, illetve ennek a helyfüggésnek a megjelenítése. A képalkotó eljárásokat több szempont szerint lehet osztályozni.
A megjelenítés történhet, egyebek között, egy kétdimenziós, vetületi kép formájában. Ilyen képet eredményez a korai képalkotó eljárások között kiemelkedő jelentőségű (és ma is alapvető jelentőséggel bíró) hagyományos röntgen technika. Ebben az esetben a szöveteknek a sugárzást elnyelő (vagy gyengítő) képessége az a fizikai tulajdonság, amely a technikával tanulmányozható. A módszerrel a vizsgált biológiai rendszernek (illetve a helyfüggő sugárzásgyengítő képességnek) csak a vetületi képe állítható elő. A technika tökéletlenségeire utal, hogy az ilyen kép semmilyen információt nem hordoz a strukturális elemeknek a vetítés irányában történő lokalizációjára, valamint a struktúrának a vetítési irányban mérhető dimenzióira vonatkozóan.
Az említett hátrányoktól mentesek a tomografikus (rétegvizsgálatokra alkalmas) módszerek. Ezeknek a technikáknak a segítségével a tanulmányozott rendszer vékony síkmetszetei mentén (egy vékony szeletről) is megoldható a megfelelő sajátosságok feltérképezése. Ez a lehetőség a szeletek számának a növelése révén végeredményben lehetővé teszi a struktúra háromdimenziós vizsgálatát.
Egy másik típusú osztályozás aszerint történik, hogy a megjelenített tulajdonság a rendszer struktúrájával, vagy funkciójával kapcsolatos-e. Anatómiai információt eredményeznek a röntgen abszorpciós sajátságokat térképező radiológiai módszerek, a mágneses rezonanciás tomografikus módszer, valamint szinte minden ultrahang diagnosztikai eljárás. Funkcionális leképezést jelentene, ha a vizsgált szöveti régiókban lejátszódó biokémiai folyamatok térbeli megjelenítését, tehát a szöveti biokémia térképezését lehetne megoldani. A szöveteket alkotó sejtek anyagcsere intenzitásának vizsgálata, valamint helyfüggő megjelenítése, vagy a sejtek citoplazma membránjában expresszált specifikus kötőhelyek (például neuroreceptorok, hormon kötőhelyek stb.) térbeli eloszlásának meghatározása a tanulmányozott rendszer funkciójára utaló vizsgálati eredmény.
Funkcionális képalkotó eljárások
A funkcionális vizsgálatok kivitelezéséhez könnyen megadható egy általános, két feltétel teljesedésén alapuló eljárás. Ennek a stratégiának megfelelően találni kell egy olyan anyagot (vegyületet, gyógyszerkészítményt, farmakont vagy akár sejtféleséget), amely a vizsgált rendszer meghatározott funkcióval rendelkező részein felhalmozódik. Egy-egy ilyen speciális eloszlás esetén a funkcionális képalkotáshoz elegendő a felhasználásra kerülő molekulákat alkalmas jelölővel ellátni, amely jelzők lehetővé teszik a megjelölt molekulák helyének azonosítását.
A fentiek illusztrálására megemlítjük a szervezeten belül valahol meglévő gyulladás lokalizációját. Ismert tény, hogy a gyulladások helyén a granulociták száma igen nagy mértékben megnő. Ha a vizsgálati személytől vett vérmintából izoláljuk a granulocitákat és azokat a jelölés megtörténte után visszajuttatjuk ugyanazon személy vérkeringésébe, akkor ezek a megjelölt sejtek egy meghatározott idő elteltével “bedúsúlnak" a gyulladás helyén. Alkalmas jelölési eljárásnak tűnik, ha a sejteket valamilyen gamma sugárzó radioaktív izotóppal megjelöljük. Ezek után gamma sugárzást érzékelő detektorok segítségével megállapíthatók azok a régiók, ahol a radioaktivitás az átlagosnál (a háttérnél) nagyobb, azaz a gyulladások lokalizálhatók.

Az ismertetett stratégiából rögtön következik, hogy a nukleáris medicina diagnosztikai célú képalkotó eljárásainak fejlesztése legalább két, viszonylag önálló részterületre bontható. A fejlesztés egy soha le nem zárható “műfaja" a radiofarmakon fejlesztés, aminek csak a fejlesztők fantáziája, illetve kreativitása szab határt. A farmakon fejlesztés igen szoros kapcsolatban áll az élettani, immunológiai, gyógyszertani stb. kutatásokkal, amelyek újabb és újabb hormonok, neurotranszmitterek, agonisták és antagonisták azonosításával bővítik a specifikus locuszok megjelölésére felhasználható ligandumok vagy farmakonok körét. Napjainkban is tanúi lehetünk újabb farmakonok megjelenésének, amelyek segítségével megoldhatóvá válik korábban még nem vizsgálható funkciók “térképezése". A nukleáris medicina másik, viszonylag önálló fejezete az instrumentáció. A műszer és méréstechnikai fejlesztés eredményeképpen egyre érzékenyebb, és ugyanakkor jobb térbeli felbontóképességgel rendelkező módszerek jelennek meg.
A nukleáris képalkotó módszerek igen jelentős eredményekhez segítették az élettan és a szöveti biokémia kutatóit - ez a megállapítás közhelynek számít azok számára, akik a nukleáris medicinával bármilyen közelebbi kapcsolatba kerültek. A legnagyobb eredmény kétségkívül az, hogy lehetővé vált a szervek funkcionális tanulmányozása, sőt mód van a funkciók regionális analízisére is. Ilyen módon gyakran megszüntethetők a biológiai variabilitás okozta nehézségek, amik a fiziológiai mérések során gyakran számottevő problémákat jelentenek. Vannak olyan funkcionális sajátságok, amelyek különböző egészséges személyek esetén is többszáz százalékos eltérést mutatnak egymáshoz képest, míg ugyanazon funkció regionális változása egy adott szerven belül (vagy páros szervek esetén) ennek töredéke. Ez magyarázza, hogy a nukleáris medicina lehetővé teszi a funkció regionális megjelenésében meglévő rendellenességek diagnosztizálását, még mielőtt az egész szerv teljes (integrális) funkciója kívül esne a normál kontroll értékek tartományán.
A nukleáris medicina képalkotó módszereiben alkalmazott detektorok
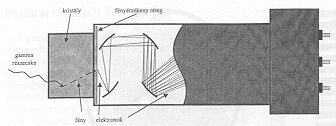
A pozitron emissziós tomográfiában szinte kizárólag szcintillációs detektorok segítségével észlelik a radioaktív jelölő izotópok bomlásából származó gamma részecskéket. A szcintillációs kristályokban a becsapódó gamma kvantumok bizonyos valószínűséggel kölcsönhatásba lépnek a detektor anyagával. Ezeknek a kölcsönhatásoknak végső soron az az eredménye, hogy a gamma-fotonok becsapódása kicsiny fény-felvillanásokat, úgynevezett szcintillációkat vált ki. Ha a kristályt több oldalról fényvisszaverő réteggel vesszük körül (lásd 1. ábra), akkor a szcintillációk során keletkezett fény fotonok a kristályhoz illesztett fotoelektron sokszorozó fotokatódjára jutnak, ahol fotoelektronokat keltenek (az elektróda egyik “kötött" elektronja a fotokatódra eső foton energiája árán “szabad elektron"-ná válik és kilép a fotokatód anyagából). A fotokatódból kiváltott primér fotoelektronok száma igen alacsony, ezért ezeknek a közvetlen detektálása nehezen oldható meg. Célszerűnek tűnik tehát ezeknek a részecskéknek a számát “megsokszorozni". A primér fotoelektronokat a fotokatód közelében elhelyezett elektródra (dinódára) össze lehet gyűjteni, ha annak potenciálja a fotokatód potenciáljához képest pozitív. Ha a potenciálkülönbség elég nagy, akkor az elektromos térerősség az elektronokat olyan energiára gyorsítja fel, hogy azok a dinódára érve abból másodlagos elektronokat "üthetnek ki". A sokszorozási tényező a dinódákat fedő fémréteg minőségétől, valamint a becsapódó elektronok kinetikai energiájától függ. Ezt a sokszorozást további dinódák alkalmazásával “tetszés-szerinti" alkalommal meg lehet ismételni. A gyakorlatban 8-12 fokozattal rendelkező elektronsokszorozókkal 106 - 108 szoros erősítés könnyen elérhető a dinódák közötti feszültség alkalmas megválasztásával.
Gamma szcintigráfiás vizsgálatok
Egy biológiai rendszerben valamilyen módon eloszló radioaktív anyag térképezése a szcintillációs kristályok alkalmazásával megoldható, ha teljesítjük a következő két feltételt: 1./ a vizsgálat tárgyát képező rendszert le kell képezni a kristály felszínére, 2./ valamilyen módon biztosítani kell, hogy a szcintillációknak ne csak a puszta észlelése történjen meg, hanem regisztrálni lehessen ezeknek a felvillanásoknak a helyét is.
Az első feltétel teljesíthető az úgynevezett kollimátorok alkalmazásával. Ha a biológiai rendszer és a kristály közé elhelyezünk egy elegendően vastag ólom lemezt, úgy a detektor a forrást “nem látja", a gamma kvantumok nem képesek a kristály anyagát gerjeszteni. A kollimátorok úgy készülnek, hogy egy ilyen ólom lemezen a felületre merőleges irányban egymással párhuzamos lyukakat állítanak elő úgy, hogy a forrást (a radiofarmakont tartalmazó biológiai rendszert) elhagyó gamma-fotonok közül csak azok érhessék el a kristályt, amelyek a lyukak tengelyével párhuzamosan, vagy közel párhuzamosan haladnak (2. ábra). Könnyen belátható, hogy a kollimátorok alkalmazásával a kristály felületén megjelenik a páciens (és a benne található radioaktivitás diagnosztikus értékű információt hordozó, háromdimenziós eloszlásának) vetületi képe.
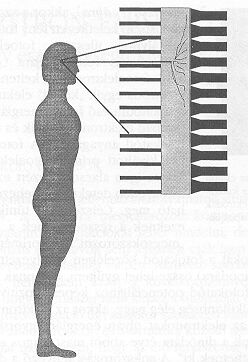
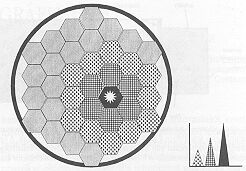
A második feltétel (a helyzetérzékeny detektálás) például olyan módon biztosítható hogy a kristályhoz nem egyetlen, a kristály méretét kevéssel meghaladó fotoelektron-sokszorozót csatlakoztatunk, hanem kisebb méretűből annyit (lásd 2-3. ábra), hogy azok a felületet teljes mértékben lefedjék. Erre a célra kifejlesztettek speciális, hatszög alakú sokszorozókat. A gyakorlatban 35-70 darab fotoelektron-sokszorozóval borítják be a szcintillációs gamma kamera kristályát. A 3. ábrán bejelöltük egy gamma-foton becsapódásának a helyét. Az a fotoelektron-sokszorozó, amelyik közvetlenül a szcintilláció felett helyezkedik el, a fényfelvillanásból sokkal több fotont gyűjt be, mint a távolabb elhelyezkedők, az egészen távoliak pedig gyakorlatilag nem észlelik a felvillanást. Ennek megfelelően egy alkalmas elektronika az összes fotoelektron-sokszorozó kimenetén megjelenő jelek alapján lokalizálni tudja a gamma-foton becsapódásának a helyét. A helyinformáció az elektronika kimenetén egy koordináta pár formájában jelenik meg, amit egy számítógép memóriájában le lehet tárolni. Sok esemény (gamma-foton becsapódása) regisztrálása után a vetületi kép rekonstrukciós programok segítségével előállítható.
Sok esetben nem teljesen kielégítő, ha a radioaktív anyag eloszlásának csak a vetületi képét lehet rekonstruálni. Ha a vetítési irány mentén is szükség van a különböző szöveti mélységben elhelyezkedő részletek megkülönböztetésére, akkor több vetítési irány mellett is el kell készíteni a vetületi képet. Ennek az a módja, hogy a detektor egy köríven körbejárja a pácienst és eközben (különböző orientációk mellett) a berendezés több, mint száz vetületi képet készít el. A sok, különböző vetítési irány mellett elkészített vetületi képből rekonstruálható a teljes, háromdimenziós eloszlás is. Ezt a módszert SPECT néven tartják számon, ami az eljárás angol elnevezésének kezdőbetűiből képezett betűszó (SPECT: Single Photon Emission Computed Tomography).
A sok különböző irányhoz tartozó vetületi kép előállítása a vizsgálati időt jelentősen megnyújtja. Planáris szcintigráfiás vizsgálatok esetén is előfordul a félórás, vagy ahhoz közeli időt igénylő vizsgálat. A SPECT vizsgálatok ennél nagyobb időigénye csökkenthető, ha a berendezések két, vagy három szcintillációs kristályt tartalmaznak (így a vizsgálati idő felére, vagy harmadára csökken).
A geometriai hatékonyság, vagy effektivitás a gamma-fotonok azon hányadával mérhető, amelyet a kollimátor a kristály felé átenged. Ez a hatékonyság egy szorzat formájában állítható elő, amelyben a két szorzótényező a kollimátor felületének “le nem fedett, nyitott" hányada, illetve a detektálás hasznos térszöge. Ez utóbbi faktor természetes módon a gamma-foton energiájával változik, hiszen a “ferde irányban" haladó gamma-fotonokat kisebb energia esetén a furatokat elválasztó fal nagyobb mértékben, a nagyobb energiájú fotonokat pedig kisebb mértékben; vagy egyáltalán nem tudja blokkolni (kiszűrni). Teljesen kézenfekvő dolog, hogy az effektivitás, valamint a térbeli felbontás paraméterek egymás rovására javíthatók. Ha kisebb átmérőjű furatokat tartalmazó, vastagabb anyagból készített kollimátort alkalmazunk, a leképezés élesebb, jobb a térbeli felbontás, de ezzel együtt romlik a fényerő, hiszen a detektálás hasznos térszöge is, valamint a kollimátor felületének “átlátszó, nem lefedett" hányada is csökken. Az úgynevezett alacsony energiájú, általános célú kollimátorok effektivitása 0,0002 körüli érték, ami annyit jelent, hogy minden 5000 fotonból átlagosan csak egy éri el a szcintillációs kristályt.
Az alacsony hatékonyság azzal a nyilvánvaló hátránnyal jár, hogy a páciensbe jelentős mennyiségű radioaktív anyagot kell injektálni, hiszen a radioaktív bomlásoknak csak 2 x 10-4 része vesz részt a képalkotásban.
Pozitron Emissziós Tomográfia
A gamma szcintigráfiás vizsgálatok kis geometriai hatékonysága az alkalmazott kollimátorok igen kis fényerejével kapcsolatos. Egy-egy radioaktív atommag bomlását követően megjelenő gamma kvantum a tér minden irányában azonos valószínűséggel emittálódik, ezért annak kollimátor nélküli, puszta detektálásából a legkisebb mértékben sem lehet a bomlás helyére következtetni. Természetes dolog, hogy ha a gamma kvantumok csak egyetlen, meghatározott irányból érhetik el a detektort, a helyzetérzékeny üzemmódban működő (sok fotoelektron-sokszorozóval beborított) szcintillációs kristály alkalmazásával minden észlelt gamma kvantumhoz meg lehet határozni egy egyenest, amely átmegy a radioaktív bomlás helyén. Ennek az az ára, hogy kollimátor alkalmazásával az összes többi (tudniillik minden más irányban emittált) kvantum elől “leárnyékoljuk" a detektort és ilyen módon ezeket a kvantumokat kizárjuk a képalkotás folyamatából.
Szükségtelenné válik a kollimátor alkalmazása, ha a jelölési célra felhasznált radioaktív izotóp pozitron emisszióval bomlik. Az ilyen radioaktív bomlás a bétabomlás egy speciális válfaja, amelynek során az atommagot nem egy negatív töltésű elektron, hanem egy azzal azonos töltésű és tömegű, de pozitív elektromos töltéssel rendelkező, úgynevezett pozitron hagyja el. A bomlásból származó és a testszövetekben hamar lefékeződő pozitron a mindenütt megtalálható elektronok közül eggyel úgynevezett annihilációs kölcsönhatásba lép (a jelenséget szétsugárzásnak is szokás nevezni). Ennek során az elektron-pozitron-pár “eltűnik" és helyettük megjelenik két, 511 keV energiájú gamma kvantum. A szétsugárzó fotonok igen nagy pontossággal egymással ellenkező irányban hagyják el a kölcsönhatás helyét. Ez a tény meghatározó fontosságú a nagy geometriai hatékonyság szempontjából, hiszen a két fotonnak két kisméretű detektorral történő észlelése lehetővé teszi egy olyan térbeli egyenes kijelölését, amely keresztül halad a szétsugárzó kölcsönhatás helyén. Számos pozitronbomló izotóp esetén a bomlásból származó részecskék (pozitronok) testszövetben mért hatótávolsága szerencsés módon alig haladja meg az 1 mm távolságot, ezért a szétsugárzás, valamint a bomlás (azaz a radiofarmakon) helye igen nagy pontossággal azonos.
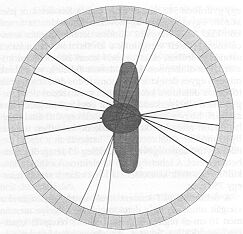
Az elmondottak úgy is megfogalmazhatók, hogy a detektált foton és annak keletkezési helye közötti kapcsolat biztosításához a pozitron emissziós technika esetén ugyanúgy szükséges a kollimálás, mint a bomlásonként egyetlen fotont detektáló szcintillációs kamera esetében. Ugyanakkor az a tény, hogy az annihilációs sugárzás két, egyidőben emittált, kollineáris, de ellenkező irányban haladó fotont tartalmaz, igen alkalmas módszert kínál ennek a sugárzásnak a detektálására, illetve az észlelt gamma-fotonok, valamint azok keletkezési helye közötti kapcsolat megállapítására. Az úgynevezett elektronikus kollimálás sémája a következő. Két sugárzási detektort (amelyek az 511 keV energiájú gamma-fotonokat észlelni képesek) egy koincidencia áramkörnek nevezett egység bemenetére kapcsolnak. Ez az áramkör akkor szolgáltat a kimenetén jelet, ha a két bemenetére egyidőben (a koincidencia kör időfelbontásánál rövidebb időn belül) érkezik jel. Az 511 keV energiájú bemenő jelekkel üzemelő koincidenciakör kimenetén megjelenő impulzus azt jelenti, hogy a két detektort összekötő egyenes mentén valahol egy szétsugárzás (tehát az egyeneshez igen közel egy pozitronbomlás) történt. Az ilyen egyenesek metszéspontjai meghatározzák a radioaktív jelölővel ellátott farmakon felhalmozódásának helyeit (4. ábra).
Könnyen belátható, hogy ha egy vizsgálati rendszert gyűrűszerűen körbeveszünk kisméretű detektorokkal, akkor a detektorgyűrű vastagsága által meghatározott rétegből a detektorgyűrű felé haladó fotonpárok a detektorrendszerrel észlelhetők. Mivel az összetartozó fotonok azonos időben “keletkeznek" az őket észlelő detektorok is azonos időben “szólalnak meg", hiszen ezek a gamma kvantumok fénysebességgel haladnak, így 10-20 cm-es úthosszkülönbséget 1 ns (10-9 szekundum)-nál kisebb időeltéréssel futnak be. Ennek megfelelően a gyűrűszerűen elhelyezett detektorok kimenő jeleit energia diszkriminátorokon vezetik át (hogy az 511 keV-től eltérő energiájú, tehát biztosan nem annihilációs kölcsönhatásból származó fotonok ne járuljanak hozzá a háttérhez) és detektor-páronként vizsgálják a jelek egyidejűségét. Az egyidőben kimenő jeleket szolgáltató detektorpárok azonosítóit számítógép memóriában tárolják. Az adatgyűjtés befejezése után a detektorgyűrű által kijelölt síkban a radioaktivitás térbeli eloszlását számítógépes programok segítségével lehet rekonstruálni a memóriában tárolt detektorpárok adatai alapján.
A vizsgált rendszer több szeletéről nyerhető egyidejűleg információ, ha azt nem egyetlen, hanem több, egymás felett elhelyezkedő detektorgyűrűvel veszik körül (a debreceni PET kamerában nyolc gyűrű és egy-egy gyűrűben 512 detektor található1). Két detektor jelei közötti egyidejűséget úgynevezett koincidencia áramkörökkel lehet vizsgálni. Minden detektor esetén koincidencia feltételt vizsgálnak a kiválasztott, valamint az azonos gyűrűben elhelyezkedő közel 200 detektor között. Hasonlóképpen koincidencia feltételt vizsgálnak minden egyes detektor és a szomszédos detektorgyűrűk többszáz detektora között is. Két szomszédos detektorgyűrűben elhelyezkedő detektor egyidejű megszólalása azt jelzi, hogy a bomlás a két detektorgyűrű által meghatározott réteg között elhelyezkedő szeletben történt. Ilyen módon a debreceni PET kamerában a nyolc detektorgyűrű segítségével egyidejűleg 15 rétegről készíthető felvétel. A lehetséges és az elektronika által külön-külön regisztrált koincidencia kapcsolatok száma mintegy 750 ezer.
A debreceni PET kamera nyolc detektorgyűrűjével a vizsgált rendszernek a detektorgyűrűk tengelye mentén mért 10 cm-es régiójáról (azon belül 15 rétegről) készíthető egyidejűleg felvétel. Az elmondottakból kitűnik, hogy egy ilyen rendszer “teljes érzékenysége" a gamma szcintillációs kamerák megfelelő adatainál több nagyságrenddel jobb. A PET vizsgálatok időigénye azonban nem csökken a gamma kamerás vizsgálatokhoz szükséges idők századrészére, hiszen itt nem egyetlen vetületi kép előállításához, hanem 15 tomográfiás rétegfelvétel előállításához kell a szükséges számú foton(pár)okat detektálni és egy-egy rétegfelvétel elkészítéséhez sok-sok, különböző irányú vetületi kép szükséges. Ha PET vizsgálatoknál is megelégednénk egyetlen vetületi kép előállításával, a vizsgálati idő a tényleges PET vizsgálati időnek a töredékére csökkenne.
A PET technika érzékenysége rendkívül nagy. Ez a módszer lehetővé teszi úgynevezett receptoroknak olyan alacsony koncentrációban történő vizsgálatát, amelyek más képalkotó eljárások számára a detektálási küszöb alatt maradnak (receptoroknak nevezik a sejtek membránján, vagy egyéb strukturális elemén megjelenő specifikus kötőhelyeket, amelyek jól meghatározott molekulák - hormonok, antitestek, neurotranszmitterek stb., általános szóhasználattal ligandok - szelektív megkötésére szolgálnak).
A módszer térbeli felbontóképessége elmarad a komputer tomográfia (CT), valamint a mágneses magrezonancián alapuló tomográfia (MRI)2 felbontóképessége mögött. Határt szab a felbontóképességnek, egyebek között, a detektorok mérete is, hiszen a detektorok a felületük dimenziójánál kisebb részletekről (tudniillik, hogy azon belül hová csapódott be a gamma kvantum) általában nem szolgáltatnak információt. A felbontásnak a detektorok mérete miatti határa leszorítható kisebb értékek felé, ha a mérés közben a detektorokat mozgatják. A körpályán végrehajtott mozgatás (úgynevezett “wobbling") során a jelek detektálásának az idejét is mérve minden egyes jelhez hozzárendelhető a detektorrendszer pontos helyzete. Ez a mérésmód ekvivalens egy olyan elrendezéssel, amelyben a valóságosnál jóval kisebb méretű detektorok találhatók. A felbontóképességet az is limitálja, hogy a két szétsugárzó gamma-foton haladási iránya nem pontosan 180 fokos szöget határoz meg. Ez a szög egy viszonylag szűk intervallumon belül, de mindenképpen változik a kölcsönható elektron-pozitron-pár impulzus viszonyaitól függő módon és mértékben.
Az eredmények kvantitatív jellege
A PET módszer egy nagy előnye több képalkotó eljárással szemben az, hogy a PET vizsgálatok eredménye abszolút egységekben skálázható. Erre az ad lehetőséget, hogy minden “vetületi képhez" meg lehet határozni az úgynevezett sugárzás gyengítési korrekciós faktorokat. Ezek a faktorok megadják, hogy a szöveti abszorpció milyen mértékben csökkenti a detektált koincidenciák számát. Könnyen belátható, hogy egy adott rendszer esetén a gyengítési tényező numerikus értéke ugyanazon detektorpár által kijelzett koincidencia eseményekre egy jól meghatározott érték, függetlenül attól, hogy a két detektort összekötő egyenes mentén hol következett be a szétsugárzásos kölcsönhatás. Ez azzal kapcsolatos, hogy a koincidencia detektálásához mindkét gamma kvantumot észlelni kell a megfelelő detektoroknak.
A korrekciós faktorok meghatározásának egy módja, hogy külső forrás alkalmazásával transzmissziós képeket készítenek az emissziós felvételekhez analóg módon. A transzmissziós adatok jó minőségét úgy lehet biztosítani, hogy a transzmissziós adatgyűjtés idejét növelik. Ilyenkor ugyanis a statisztikus ingadozások miatti zaj (ami a korrekció elvégzése után a korrigált képet is torzítja) relatíve csökken.
PET izotópok és előállításuk
A pozitron emittáló izotópok között különös jelentősége van az 15O, 13N és 11C izotópoknak, amelyek a biológiai rendszereket alkotó, legnagyobb mennyiségben előforduló elemek izotópjai. Közös vonása ennek a három izotópnak, hogy viszonylag rövid a felezési idejük, ami relatíve kis dózisok mellett is lehetővé teszi alkalmazásukat (ez abból következik, hogy a radioaktív izotópok nagy hányada már a vizsgálat alatt lebomlik). Az alacsony rendszám miatt kisenergiájú gyorsítók is alkalmasak ezen izotópok nagy hozammal történő előállítására. Ezen túlmenően, ezek az izotópok elemi formájukban, vagy egyszerű vegyületeik formájában gáz halmazállapotúak, ami tisztításuk, kezelésük során sok előnnyel jár. E három izotóppal kapcsolatos előnyök közül szinte mindegyik ráillik a 18F izotópra is, természetesen azzal a különbséggel, hogy a fluor igen toxikus és csak kevés szövetben és
|
1. táblázat |
||
|
A négy leggyakrabban alkalmazott PET izotóp magfizikai jellemzői |
||
|
Izotóp |
Felezési idő (min) |
Maximális pozitron energia (keV) |
|
18 F |
109,7 |
635 |
|
11 C |
20,4 |
960 |
|
13 N |
9,96 |
1190 |
|
15 O |
2,07 - |
1720 |
kis koncentrációban fordul elő. A PET vizsgálatokban ennek ellenére jelentős szerep jut ennek az izotópnak. A gyakori felhasználás elsősorban azzal kapcsolatos, hogy a négy könnyű PET izotóp közül ennek az izotópnak a leghosszabb a felezési ideje, valamint, hogy a PET módszer nagy érzékenysége miatt az alkalmazott F koncentrációk messze a toxikus határok alatt maradnak. Az 1. táblázatban összefoglaltuk a négy könnyű PET izotóp néhány magfizikai jellemzőjét.
Az élő szervezetekben jelentős mennyiségben található könnyű elemek pozitronemisszióval bomló izotópjainak felezési ideje a perces tartományba esik. Ezek a rövid felezési idők hosszú időn keresztül akadályozták, néhány esetben ma is akadályozzák a fenti izotópoknak, mint radioaktív jelölőknek az alkalmazását. A rendkívül gyors kémiai és radiokémiai műveletek, illetve teljes “előállítási-gyártási technológiák" kidolgozása sok találékonyságot és gyakran igen hosszú fejlesztést igényel. Ugyanakkor tisztán kell látni a gyors lebomlás jelentette előnyöket is, hiszen pontosan ezek a rövid felezési idők teremtik meg a lehetőséget arra, hogy relatíve nagy aktivitásokat lehessen alkalmazni a vizsgálatokban (és ilyen módon viszonylag rövididejű adatgyűjtéssel is kellő statisztikával rendelkező, jó minőségű felvételeket lehessen készíteni, anélkül, hogy a vizsgálati személyt túlságosan nagy sugárdózis érné. Ha ugyanis a vizsgálat időtartama egy felezési idő (például 10-20 perc), úgy annak során a páciensbe bejuttatott aktivitásnak a fele lebomlik a vizsgálat végére, tehát a teljes aktivitásnak a felét lehet felhasználni a képalkotás céljaira. Ezzel szemben hosszabb (például 1 nap) felezési idejű izotópok alkalmazása esetén ez a “kihasználható hányad" messze az 1 % alatt marad, ha eltekintünk a “biológiai bomlástól" (attól tudniillik, hogy a bevitt radiofarmakonok a szervezetből az anyagcserefolyamatok során meghatározott sebességgel kiürülnek). A rövid felezési idők lehetővé teszik, hogy bizonyos vizsgálatokat igen rövid időn belül (akár néhány percen belül) meg lehessen ismételni az előzőleg kivitelezett vizsgálatokból visszamaradt radiofarmakon zavaró hatása nélkül.
Ezeket az izotópokat ciklotron besugárzással az 1930-as évektől kezdődően tudják előállítani. A lehetőség megteremtése után a biológiai vizsgálatokban történő felhasználásuk azonnal megkezdődött. Az 1940-es években került sor az első humán vizsgálatokra. Az első alkalmazásokból a legrövidebb felezési idejű 'S0 izotóp természetesen kimaradt.
Az 1. táblázatban feltüntetett izotópok rövid felezési ideje miatt ezen izotópokat alkalmazó PET kamerákat közvetlenül gyorsítók mellé telepítik. Talán az egyetlen kivétel a 18F, ami lehetővé teszi a jól szervezett szállítást. Természetes módon ezeknek az izotópoknak, vagy az azokkal megjelölt farmakonoknak a készletezését sem lehet megoldani.
A PET vizsgálatok során a szétsugárzó gamma kvantumok észlelése jelenti a ténylegesen detektált, primér jeleket, mint azt az előzőekben részleteztük. Ennek megfejelően az 511 keV-es gamma-fotonok észlelésére alkalmas detektorok minden PET kamera igen kritikus komponensei. Az ilyen sugárzás érzékelők leglényegesebb tulajdonságai:
A nagy érzékenység még a nukleáris medicinában megszokott jelentőségnél is nagyobb fontosságú, hiszen a koincidencia feltétel miatt a PET technikában a beütésszám ennek a négyzetével arányos. További kritikus szempontok a stabilitás, megbízhatóság, valamint az alacsony ár, hiszen egy kamerában többezer detektor található.
Több laboratóriumban próbálkoztak sok-anódszálas (multiwire) proporcionális számlálóknak az alkalmazásával. Ezek a detektorok olyan, gázzal töltött proporcionális számlálók, amelyekben egy rácsszerűen strukturált anódszál rendszer lehetővé teszi az ionizációs eseménynek kétdimenziós lokalizálását. Egy ilyen detektorrendszer előnyei közé tartozik a jó térbeli felbontás (megfelelő tervezés esetén néhány milliméter), a konstrukció egyszerűsége és az alacsony ár. A PET alkalmazások szempontjából alapvető hátrány a kis detektálási hatásfok, hiszen a detektálás alapjául szolgáló ionizációs folyamat egy alacsony sűrűségű gáz atmoszférában játszódik le. Ez az alacsony detektálási hatásfok jelentős mértékben javítható, ha a detektor rendszert nagy sűrűségű konverterrel (például ólom lemez) veszik körül. A szétsugárzó gamma-fotonok a konverter anyagában viszonylag nagy valószínűséggel keltenek fotoelektronokat, vagy Compton-elektronokat. Ezeknek a másodlagos részecskéknek az észlelése már nagyobb hatásfokkal történhet és a helyzetérzékeny detektálási lehetőség még mindig megmarad. Hátrányos, hogy a detektor érzékenység még a konverterekkel körülvett rendszer esetén sem haladja meg az 5 % értéket, valamint, hogy a lassú jelek miatt a koincidencia felbontási idő hosszú.
Napjainkban szinte kizárólag szcintillációs detektorokat alkalmaznak sugárzás detektorként. Az ilyen detektorok egy szcintillációs kristályból és egy fotoelektron-sokszorozóból állnak, amely egységeket optikailag csatolják egymáshoz. A kristályban az ionizáló sugárzás fluoreszcenciás felvillanásokat kelt, amelyeket a fotoelektronsokszorozó elektromos impulzusokká alakít. Az első PET kamerákban talliummal aktivált NaI kristályokat használtak, amelyeket a későbbiek során cézium fluorid, bárium
|
2. táblázat |
||||
|
Szcintillációs kristályok jellemző paraméterei |
||||
|
Detektor anyag |
NaI |
CsF |
BaF2 |
Bi4Ge3O12 |
|
Relatív fényhozam |
1 |
0,05 |
0,05-0,16 |
0,12 |
|
Bomlásidő (ns) |
230 |
5 |
0,8-620 |
300 |
|
Sűrűség (g/cm3) |
3,67 |
4,64 |
4,89 |
7,13 |
|
Lineáris gyengítési tényező 511 keV-nél (1/cm) |
0,34 |
0,44 |
0,47 |
0,92 |
fluorid és bizmut germanát kristályokkal váltottak fel. Ezekkel a detektorokkal jobb detektálási hatásfokot (BiGeO), illetve 500 ps alatti koincidencia időfelbontást (CsF, BaF) lehet elérni. Néhány szcintillátornak az alkalmazás szempontjából kritikus jellemzőit a 2. táblázat tartalmazza. A szcintillációs detektorok alkalmazásának legfőbb hátránya, hogy terjedelmesek és nehezen illeszthetők jó térbeli felbontású detektorrendszerbe. Mai, szériagyártásban készülő kamerák egyedi detektorra vonatkoztatott hatásfoka 90 % körüli érték, (ami koincidencia események detektálására 80 %-ot jelent), az időfelbontás pedig 10-20 ns.
A Pozitron Emissziós Tomográfia alkalmazási lehetőségei
A PET eljárások előnyei egyebek között azzal kapcsolatosak, hogy ez a vizsgálati módszer csak részben fizikai természetű. Az egyrészt természetes, hogy a radioaktivitás detektálása, valamint a számítógép memóriában letárolt adatokból a térbeli eloszlás rekonstruálása tisztán fizikai-számítástechnikai feladat, ám legalább ilyen fontos az a tény, hogy a radioaktivitás funkcionális sajátosságok alapján akkumulálódik, illetve lokalizálódik. Azok a funkcionális sajátosságok, amelyek megszabják a radiofarmakon térbeli eloszlását, mindig a konkrét farmakon molekula sajátosságaitól függenek. Ebből a szempontból az a meghatározó, hogy az illető molekula az élő szervezeten belül milyen folyamatokban vesz részt. Ezek a folyamatok lehetnek a szervezeten belül lejátszódó biokémiai reakciók, de lehetnek egyszerű fiziko-kémiai folyamatok (például különböző fázisok közötti megoszlás), vagy hasonlóképpen egyszerű, de az élő szervezet szempontjából rendkívüli jelentőséggel bíró kötődési folyamatok, amelyek során egy-egy biológiailag “aktív" molekula, egy-egy specifikus helyre kötődik. Ilyen nagy specificitású kötődési folyamatok játszódnak le az antigének és az ellenük termelt antitestek, a hormonok, neurotranszmitterek és a receptoraik között stb. Ezek a kötődési folyamatok a fiziológiás, illetve kóros funkció során igen nagy mértékben eltérhetnek egymástól. Megváltozhat a kötőhelyek koncentrációja, de módosulhat a kötés erősségét meghatározó kötődési állandó numerikus értéke is.
A klinikai alkalmazások közül kiemelkedik a tumordiagnosztika. Ez a módszer lehetővé teszi a viszonylag kis kiterjedésű, de fokozott anyagcseréjű tumorszövetek pontos kimutatását a szervezetben. A módszer más képalkotó eljárásokkal együttesen rendkívül megbízható tájékoztatást ad a kezelő orvosnak a tumorok pontos kiterjedéséről, a tumor növekedés mértékéről, valamint támpontot ad az optimális terápia megválasztásához. Ismételt PET vizsgálatokkal megítélhető az alkalmazott terápia eredményessége, jelzi a terápia módosításának esetleges szükségességét.
A módszert napjainkig az ideggyógyászok és idegsebészek használták a leggyakrabban a központi idegrendszeri tumorok diagnosztikájában, de igen gyakran alkalmazzák lágyrész tumorok (vastagbél, végbél, emlő, tüdő, izom) és csonttumorok azonosításában, terápiájuk beállításában és követésében is.
Bizonyos típusú agydaganatos megbetegedések esetén a daganat anyagcseréjének vizsgálatával még a műtétek előtt információ nyerhető az elváltozás biológiai természetéről. Ilyen vizsgálatok eredményeképpen megbecsülhető, hogy a betegség milyen lefolyású lesz. Amennyiben szövettani vizsgálatok céljából mintavétel szükséges, úgy a PET felvételek segítségével pontosan behatárolható az a régió, amely erre a célra a legalkalmasabb. A daganatok műtéti eltávolítását követően már az operációt követő napokban tisztázni lehet, hogy az eltávolítás teljes volt-e? Ilyen kérdések eldöntéséhez az egyébként széleskörben használt CT, illetve MRI módszerek csak korlátozottan nyújtanak támpontot.
Számos esetben szükség van műtét utáni sugárkezelésre is. A nagy érzékenységű PET vizsgálatok nagyon értékes segítséget nyújtanak a besugárzás tervezéshez, hiszen nagy pontossággal kijelölik a céltérfogatot. A sugárkezelés megtörténte után gyakran ellenőrzik annak hatékonyságát. Ennek során meg kell állapítani, hogy a sugárterápia elérte-e célját, vagy a daganat egy hányada túlélte a kezelést.
Gyakran előfordul, hogy az ellenőrző vizsgálatok röntgenfelvételein szövetszaporulat észlelhető. Ez utalhat kiújuló daganatra, de nem különböztethető meg egyértelműen a sugárkezelés következtében kialakult szöveti elhalástól. FDG-PET vizsgálatokkal ez a két egymástól eltérően kezelendő kórkép teljes biztonsággal elkülöníthető.
Kiemelkedő jelentősége van a módszernek epilepsziákban, mert lehetővé teszi az epileptikus gócok lokalizációját. Fontosak a kardiológiai alkalmazások: szívműtétek előtt a szív izomzat funkcionális állapotáról, az élő és elhalt szöveti részek arányáról, ezen régiók térbeli elhelyezkedéséről kap a szívsebész pontos és más módszerrel nem pótolható információt, s a szívműtét után annak sikeréről, esetleges további gyógyszeres kezelés beállításának szükségességéről győződhet meg.
____________________
A debreceni PET kamerát 1994. január 26-án helyezték üzembe. Mintegy fél évvel később végezték el az első humán vizsgálatokat. A debreceni PET Centrum Közép- és Kelet-Európa ma is egyetlen ilyen létesítménye.
____________________
1 A debreceni PET kamera egésztest vizsgálatokra alkalmas (lásd később), típusa GE 4096PLUS, a General Electric cég szállította. A térbeli felbontóképességet, érzékenységet, az alkalmazhatóságot, valamint az egész berendezés teljesítőképességét illetően ez a kamera a piacon elérhető legjobb kamerák egyike.
2 A módszerre a magnetic resonance imaging megnevezés kezdőbetűiből képzett betűszóval hivatkoznak, hogy elkerüljék a nukleáris szóval járó kellemetlen asszociációkat.